
| A. | 灼烧的铁丝在氯气中燃烧,集气瓶内充满棕黄色烟雾 | |
| B. | 氢气在氯气中燃烧,集气瓶口有白雾 | |
| C. | 向盛水的烧杯中先加入过氧化钠,再滴加酚酞,最终溶液呈红色 | |
| D. | 将Cl2通入紫色石蕊溶液中,溶液变红色 |
分析 A.铁和氯气生成氯化铁固体;
B.氢气与氯气反应生成HCl气体;
C.过氧化钠具有漂白性;
D.氯气与水反应生成HCl、HClO,HClO具有漂白性.
解答 解:A.铁和氯气生成氯化铁固体,燃烧时观察到集气瓶内产生红棕色烟,故A错误;
B.氢气与氯气反应生成HCl气体,HCl极易结合水蒸气,观察到集气瓶口有白雾,故B正确;
C.向盛水的烧杯中先加入过氧化钠,再滴加酚酞,溶液先变红色,后又褪色,故C错误;
D.氯气与水反应生成HCl、HClO,则氯气通入石蕊试液先变红后褪色,故D错误;
故选B.
点评 本题考查氯气、钠的化学性质,把握氯气的化学反应及现象为解答的关键,注意AB中现象的区别,明确烟与雾的区别,题目难度不大.


科目:高中化学 来源: 题型:解答题
 氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
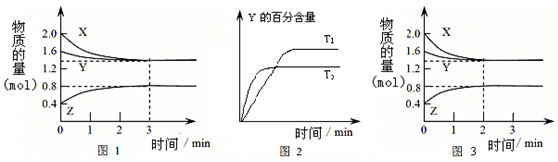
| A. | 容器中发生的反应可表示为:3X(g)+Y(g)?2Z(g) | |
| B. | 0~3min内,v(X)=0.1 mol/(L•min) | |
| C. | 达平衡后,升高温度,v正、v逆都增大,且再次平衡前v正<v逆 | |
| D. | 若改变条件,使反应进程如图3所示,则改变的条件可能是增大压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与醋酸反应:Fe+2H+═Fe2++H2↑ | |
| B. | 硫酸铜溶液与氢氢化钡溶液混合:Ba2++SO42-═BaSO4↓ | |
| C. | 铜与硝酸银溶液反应:Cu+Ag+═Cu2++Ag | |
| D. | 碳酸氢钙与盐酸反应:HCO3-+H+═H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、NO3-、Mg2+、OH- | B. | MnO4-、K+、CO32-、Na+ | ||
| C. | K+、SO42-、HCO3-、Na+ | D. | NH4+、SO42-、K+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑦ | B. | ①②⑥⑧ | C. | ①③④⑧ | D. | ①③⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验②证明了①的滤液中含有Ag+,由此推断的滤液中也含有Cl- | |
| B. | 由实验③推测:若在①的沉淀中滴加NaOH溶液,沉淀也能溶解 | |
| C. | 实验的溶液中含有[Ag(NH3)2]+微粒 | |
| D. | 实验证明了该温度下Ag2S比Ag2SO4更难溶解 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com