
| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76.8 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
分析 (1)①用△G=△H-T•△S来判断反应能否发生;
②向TiO2(s)+2Cl2(g)?TiCl4(l)+O2(g)反应体系中加C,能反应掉生成物O2,从化学平衡移动的角度分析;
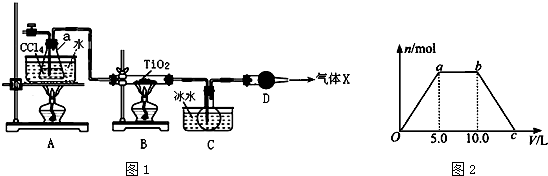
(2)为防止产品TiCl4被氧化,实验开始时先点燃A处的酒精灯,使四氯化碳挥发,排尽系统(装置)中的空气,待C中烧瓶里有液滴出现时再点燃B处的酒精灯,B中装置在加热条件下,发生反应TiO2(s)+CCl4(g)$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4(g)+CO2(g),CCl4、TiCl4熔点较低,C装置使这两种物质转化为液态,二者能互溶,应该采用蒸馏方法分离,D装置连接空气,由于TiCl4遇潮湿空气产生白雾,发生水解反应,故D装置作用是防止空气中水蒸进入.
①为防止产品TiCl4被氧化,先排尽系统(装置)中的空气;
②水浴加热优点是受热均匀,能为反应提供稳定的CCl4蒸汽流;
③TiO2和 CCl4为在加热条件下生成TiCl4和CO2;
④CCl4、TiCl4二者能互溶,应该采用蒸馏方法分离;
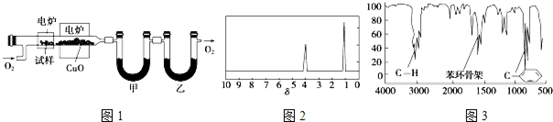
⑤向NaOH和Ba(OH)2的混合稀溶液中通入CO2,开始产生沉淀,故a点之前发生反应:CO2+Ba(OH)2=BaCO3↓+H2O,a~b之间先后发生的反应为:2NaOH+CO2═Na2CO3、Na2CO3+H2O+CO2═2NaHCO3,总反应为:NaOH+CO2═NaHCO3,b~c之间发生反应:BaCO3+H2O+CO2═Ba(HCO3)2,由方程式可知生成碳酸钡沉淀与碳酸钡溶解消耗二氧化碳的体积相等,根据氢氧化钡、氢氧化钠消耗二氧化碳体积计算溶液中Ba(OH)2和NaOH的浓度之比.
解答 解:(1)①TiO2(s)+2Cl2(g)?TiCl4(1)+O2(g)△H=+151kJ/mol该反应中,反应物有2mol气体,生成物只有1mol气体,△S<0,又△H>0,则△G=△H-T•△S>0,故反应不能自发进行,
故答案为:反应不能自发进行,因为此反应中△H>0,△S<0,△G=△H-T•△S>0,故此反应不能自发进行;
②在反应TiO2(s)+2Cl2(g)?TiCl4(l)+O2(g)中,加入C能和O2反应C(s)+O2(g)=CO2(g),降低了O2的浓度,平衡正向移动,反应就可以进行了,
故答案为:加入的碳单质与氧气反应,减小了产物O2的浓度,使 TiO2(s)+2Cl2(g)?TiCl4(l)+O2(g)平衡向正反应方向移动,使反应能够顺利进行;
(2)为防止产品TiCl4被氧化,实验开始时先点燃A处的酒精灯,使四氯化碳挥发,排尽系统(装置)中的空气,待C中烧瓶里有液滴出现时再点燃B处的酒精灯,B中装置在加热条件下,发生反应TiO2(s)+CCl4(g)$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4(g)+CO2(g),CCl4、TiCl4熔点较低,C装置使这两种物质转化为液态,二者能互溶,应该采用蒸馏方法分离,D装置连接空气,由于TiCl4遇潮湿空气产生白雾,发生水解反应,故D装置作用是防止空气中水蒸进入.
①为防止产品TiCl4被氧化,先排尽系统(装置)中的空气,
故答案为:先排尽系统(装置)中的空气;
②水浴加热优点是受热均匀,能为反应提供稳定的CCl4蒸汽流,
故答案为:受热均匀,能为反应提供稳定的CCl4蒸汽流;
③TiO2和 CCl4为在加热条件下生成TiCl4和CO2,
故答案为:TiO2+CCl4$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4+CO2↑;
④CCl4、TiCl4二者能互溶,应该采用蒸馏方法分离,
故答案为:蒸馏;
⑤向NaOH和Ba(OH)2的混合稀溶液中通入CO2,开始产生沉淀,故a点之前发生反应:CO2+Ba(OH)2=BaCO3↓+H2O,a~b之间先后发生的反应为:2NaOH+CO2═Na2CO3、Na2CO3+H2O+CO2═2NaHCO3,总反应为:NaOH+CO2═NaHCO3,b~c之间发生反应:BaCO3+H2O+CO2═Ba(HCO3)2,
从图中可知:氢氧化钡、氢氧化钠消耗二氧化碳体积分别为5L、5L,结合方程式CO2+Ba(OH)2=BaCO3↓+H2O,NaOH+CO2═NaHCO3可知溶液中Ba(OH)2和NaOH的浓度之比为1:1,
a点到b点依次发生的第一个反应的离子方程式是:CO2+2OH-=CO32-+H2O;
故答案为:1:1;CO2+2OH-=CO32-+H2O.
点评 本题考查实验制备方案,明确原理是解题关键,侧重考查学生装置的分析评价,注意对题目信息的提取与应用,是对学生综合能力的考查,题目难度中等.


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:解答题
 .
. 、
、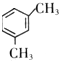 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③⑤ | C. | ③④⑤ | D. | ②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑤ | B. | ②④⑤ | C. | ②③④⑤ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 黄曲霉素、亚硝胺及3,4-苯并芘是世界公认的三大强烈致癌物质,3,4-苯并芘是一种稠环芳烃,其结构简式如图所示,则一氯3,4-苯并芘有( )
黄曲霉素、亚硝胺及3,4-苯并芘是世界公认的三大强烈致癌物质,3,4-苯并芘是一种稠环芳烃,其结构简式如图所示,则一氯3,4-苯并芘有( )| A. | 8种 | B. | 10种 | C. | 12种 | D. | 20种 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚石和SiO2 | B. | CO2和SiO2 | C. | NaCl和 HCl | D. | 钠和KCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
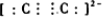 ,其中α键和π键数目之比为1:2.
,其中α键和π键数目之比为1:2.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com