
分析 溶液中的氢离子既包括硝酸电离的又包括硫酸电离的.所以n(H+)=3mol•L-1×0.01L×1+3mol•L-1×0.01L×2=0.09mol,n(NO3-)=3mol•L-1×0.01L=0.03mol,
n(Cu)=$\frac{1.92g}{64g/mol}$=0.03mol,结合反应的离子方程式3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O解答该题.
解答 解:溶液中的氢离子既包括硝酸电离的又包括硫酸电离的.所以n(H+)=3mol•L-1×0.01L×1+3mol•L-1×0.01L×2=0.09mol,n(NO3-)=3mol•L-1×0.01L=0.03mol,
n(Cu)=$\frac{1.92g}{64g/mol}$=0.03mol,则
3Cu+8H++2NO3-=3 Cu2++2NO↑+4H2O
3 8 2 3 2
0.03 0.09 0.03
可知Cu完全反应,H+和NO3-过量,则
(1)由反应的离子方程式可知:n(NO)=$\frac{0.03mol×2}{3}$=0.02mol,V(NO)=0.02mol×22.4L/mol=0.448L,
答:产生的气体在标准状况下的体积是0.448L;
(2)0.03molCu完全反应,则生成0.03molCu2+,消耗n(H+)=$\frac{0.03mol×8}{3}$=0.08mol,剩余n(H+)=0.09mol-0.08mol=0.01mol,消耗n(NO3-)=n(NO)=0.02mol,则剩余n(NO3-)=0.03mol-0.02mol=0.01mol,
所以反应后溶液中c(Cu2+)=$\frac{0.03mol}{0.01L}$=3mol/L,c(H+)=$\frac{0.01mol}{0.01L}$=1mol/L,c(NO3-)=$\frac{0.01mol}{0.01L}$=1mol/L,
由于SO42-没有参加反应,反应后的浓度仍为3mol/L,
答:反应后溶液中各溶质离子物质的量浓度分别为Cu2+:3mol/L,H+:1mol/L,NO3-:1mol/L,SO42-:3mol/L.
点评 本题考查混合物反应的计算,为高考高频考点,题目难度中等,试题侧重于学生的分析能力和计算能力的考查,明确发生反应的实质为解答关键,试题培养了学生的化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L H2O含有的分子数为NA | |
| B. | 常温常压下,1.06克Na2CO3含有的Na离子数为0.02NA | |
| C. | 通常状况下,1NA个H2分子占有的体积为22.4L | |
| D. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl离子个数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、H+、SO32-、H2O2 | B. | Al3+、Mg2+、OH-、CO32- | ||
| C. | K+、OH-、Cl-、NH3•H2O | D. | Ba2+、Fe3+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | lmolNa与足量的02反应生成Na20和Na2O2,失去的电子数为NA | |
| B. | 标准状况下,44.8LHF所含分子数为2NA | |
| C. | 在碳酸钠溶液中,若c(C032-)=lmol•L-1,则c(Na+)=2mol•L-l | |
| D. | 已知2SO2(g)+02(g)?2SO3(g);△H=-akJ.mol-l将2NA个SO2与NA个02混合充分反应放出akJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 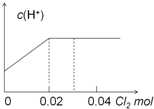 | B. | 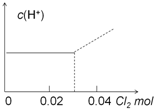 | ||
| C. | 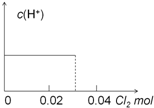 | D. | 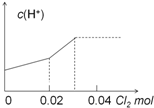 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ④⑤⑥ | C. | ②③④ | D. | ②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 实验 | 现象 | 结论 |
| A | 取少量食盐溶于水,加稀硫酸酸化,再滴入淀粉溶液 | 溶液未呈蓝色 | 该食盐中不含有碘酸钾 |
| B | 将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡、静置 | 下层溶液显紫红色 | Fe3+的氧化性大于I2 |
| C | 向蛋白质溶液中加入CuCl2或(NH4)2SO4饱和溶液 | 均有沉淀 | 蛋白质均发生了变性 |
| D | 将0.1mol•L-1 MgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1mol•L-1CuSO4溶液 | 白色沉淀逐渐变为蓝色沉淀 | Ksp[Cu(OH)2]< Ksp[Mg(OH)2] |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨易溶解于水,因此可用来作喷泉实验 | |
| B. | 与金属反应时,稀HNO3可能被还原为更低价态,则稀HNO3氧化性强于浓HNO3 | |
| C. | 铵盐受热易分解,因此贮存氨态氮肥时要密封保存,并放在阴凉通风处 | |
| D. | 实验室可用氢氧化钠溶液处理含有二氧化硫和氯气的尾气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
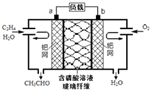 乙烯催化氧化成乙醛可设计成如图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:2CH2=CH2+O2→2CH3CHO.下列有关说法正确的是( )
乙烯催化氧化成乙醛可设计成如图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:2CH2=CH2+O2→2CH3CHO.下列有关说法正确的是( )| A. | a电极发生还原反应 | |
| B. | 放电时,每转移2mol电子,理论上需要消耗28g乙烯 | |
| C. | b极反应式为:O2+4e-+2H2O═4OH- | |
| D. | 电子移动方向:电极a→磷酸溶液→电极b |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com