工业合成氨与制备硝酸一般可连续生产,流程如下:

(1)工业生产时,制取氢气的一个反应为:CO+H
2O(g)?CO
2+H
2①t℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气.反应建立平衡后,体系中c(H
2)=0.12mol?L
-1.该温度下此反应的平衡常数K=
1
1
(填计算结果).
②保持温度不变,向上述平衡体系中再加入0.1molCO,当反应重新建立平衡时,水蒸气的转化率α(H
2O)=
50%
50%
.
(2)合成塔中发生反应N
2(g)+3H
2(g)?2NH
3(g);△H<0.下表为不同温度下该反应的平衡常数.由此可推知,表中
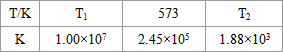
T
1<
<
573K(填“>”、“<”或“=”).

(3)NH
3和O
2在铂系催化剂作用下从145℃就开始反应:4NH
3(g)+5O
2(g)?4NO(g)+6H
2O(g)△H=-905kJ?mol
-1,不同温度下NO产率如右图所示.温度高于900℃时,NO产率下降的原因
温度高于900℃时,平衡向左移动
温度高于900℃时,平衡向左移动
.
(4)废水中的N、P元素是造成水体富营养化的关键因素,农药厂排放的废水中常含有较多的NH
4+和PO
43-,一般可以通过两种方法将其除去.
①方法一:将Ca(OH)
2或CaO 投加到待处理的废水中,生成磷酸钙,从而进行回收.当处理后的废水中c(Ca
2+)=2×10
-7 mol/L时,溶液中c(PO
43-)=
5×10-7
5×10-7
mol/L.
(已知K
sp[Ca
3(PO
4)
2]=2×10
-33)
②方法二:在废水中加入镁矿工业废水,就可以生成高品位的磷矿石-鸟粪石,反应的方程式为Mg
2++NH
4++PO
43-=MgNH
4PO
4↓.该方法中需要控制污水的pH为7.5~10,若pH高于10.7,鸟粪石的产量会大大降低.其原因可能为
当pH高于10.7时,溶液中的Mg2+、NH4+会与OH-反应,平衡向逆反应方向移动
当pH高于10.7时,溶液中的Mg2+、NH4+会与OH-反应,平衡向逆反应方向移动
.与方法一相比,方法二的优点为
能同时除去废水中的氮,充分利用了镁矿工业废水
能同时除去废水中的氮,充分利用了镁矿工业废水
.

 2CO
2CO 4Fe+3CO2↑
4Fe+3CO2↑ Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑ 

 (3)NH3和O2在铂系催化剂作用下从145℃就开始反应:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-905kJ?mol-1,不同温度下NO产率如右图所示.温度高于900℃时,NO产率下降的原因
(3)NH3和O2在铂系催化剂作用下从145℃就开始反应:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-905kJ?mol-1,不同温度下NO产率如右图所示.温度高于900℃时,NO产率下降的原因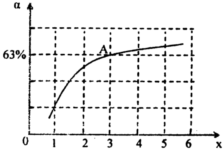 (2013?河西区一模)肼(N2H4)和氨是氮的两种常见化合物,在科学技术和生产中有广泛应用.请按要求回答下列问题:
(2013?河西区一模)肼(N2H4)和氨是氮的两种常见化合物,在科学技术和生产中有广泛应用.请按要求回答下列问题: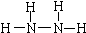
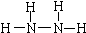
 如图所示装置有多种用途,请回答下列问题:
如图所示装置有多种用途,请回答下列问题: