
| A. | 铵态氮肥和草木灰混合使用可增加肥效 | |
| B. | 氢氟酸刻蚀水晶饰品体现其酸性 | |
| C. | 电渗析法、蒸馏法、离子交换法是海水淡化的常用方法 | |
| D. | 煤经过气化和液化等物理变化可转为清洁能源 |
分析 A.铵态氮肥与草木灰混合,溶液中铵根离子和碳酸根离子发生双水解反应生成二氧化碳和氨气;
B.HF能和二氧化硅反应生成四氟化硅和水;
C.海水淡化就是将海水中的可溶性杂质除去的过程;
D.煤的气化和液化都属于化学变化.
解答 解:A.铵盐遇显碱性的草木灰生成氨气,降低肥效,铵态氮肥不应跟碱性物质混合使用,故A错误;
B.HF能和二氧化硅反应生成四氟化硅和水,该反应中不是生成盐和水,所以HF没有体现酸性,故B错误;
C.海水淡化就是将海水中的可溶性杂质除去的过程,蒸馏法是把水从水的混合物中分离出来,得到纯净的水;利用电渗析法可使相应的离子通过半透膜以达到硬水软化的效果;
通过离子交换树脂可以除去海水中的离子,从而达到淡化海水的目的,这几种方法操作较方便且可行性强,
所以电渗析法、蒸馏法、离子交换法是海水淡化的常用方法,故C正确;
D.煤的气化是煤在氧气不足的条件下进行部分氧化形成H2、CO等气体的过程,煤的液化是将煤与H2在催化剂作用下转化为液体燃料或利用煤产生的H2和CO通过化学合成产生液体燃料或其他液体化工产品的过程,所以煤经过气化和液化等变化是化学变化,故D错误;
故选C.
点评 本题考查化学与生活,为高频考点,属于基础题,明确物质性质及化学在生活中的应用是解本题关键,注意D中属于化学变化而不是物理变化,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | 二氧化碳使Na2O2固体变白 | B. | 氯气使KBr溶液变黄 | ||
| C. | 乙烯使Br2的四氯化碳溶液褪色 | D. | 氨气使AlCl3溶液产生白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 夏天设定空调温度尽可能的低 | B. | 推广使用一次性塑料袋和纸巾 | ||
| C. | 少开私家车多乘公共交通工具 | D. | 对商品进行豪华包装促进销售 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稳定性:NH3>H2O>HF | B. | 离子半径:Na+<Mg2+<Al3+ | ||
| C. | 酸性:HClO4>H2SO4>H2CO3 | D. | 金属还原性:Mg>Ca |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 装置①可用于实验室制取少量 NH3或 O2 | |
| B. | 可用从 a 处加水的方法检验装置②的气密性 | |
| C. | 实验室可用装置③收集 H2、NH3 | |
| D. | 利用装置④制硫酸和氢氧化钠,其中 b 为阳离子交换膜、c 为阴离子交换膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯水显酸性的主要原因:HClO?H++ClO- | |
| B. | 向氯水中滴加少量NaHCO3溶液:H++HCO3-═CO2↑+H2O | |
| C. | SO2具有漂白性,向氯水中通入少量SO2,溶液的漂白能力降低 | |
| D. | 常温时,氯水中含有的阴离子:Cl-、ClO-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.  .
. $→_{K_{2}CO_{3}}^{(CH_{3})_{2}SO_{4}}$
$→_{K_{2}CO_{3}}^{(CH_{3})_{2}SO_{4}}$ (R代表烃基,R'代表烃基或H) 请写出以
(R代表烃基,R'代表烃基或H) 请写出以 和(CH3)2SO4为原料制备
和(CH3)2SO4为原料制备 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干).
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
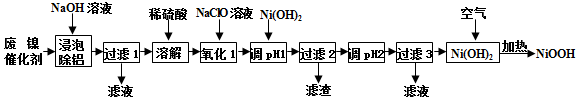
| 开始沉淀的pH | 完全沉淀的pH | |
| Ni2+ | 6.2 | 8.6 |
| Fe2+ | 7.6 | 9.1 |
| Fe3+ | 2.3 | 3.3 |
| Cr3+ | 4.5 | 5.6 |
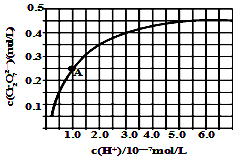
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
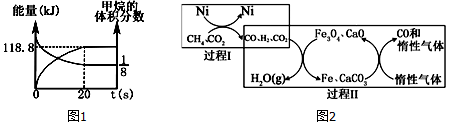
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com