
已知:△H为焓变,△S熵变,下列叙述中正确的是( )
A.△S大于零的反应肯定能自发进行
B.△H小于零且△S大于零的反应一定能自发进行
C.△H小于零的反应肯定能自发进行
D.△H大于 零且△S大于零的反应一定能自发进行
零且△S大于零的反应一定能自发进行
科目:高中化学 来源:2016-2017学年福建省宁德市高二上期中化学试卷(解析版) 题型:实验题
废铅蓄电池量急速增加所引起的铅污染日益严重。工业上从废铅蓄电池的铅膏中回收铅的工艺流程如下:
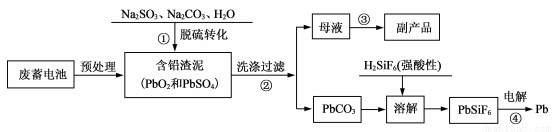
(1)铅蓄电池的总反应为Pb+ PbO2+2H2SO4 =2PbSO4+2H2O,该蓄电池放电时的负极反应式为__________,放电后该电极质量_______(填“增大”“减小”或“不变”)。
(2)步骤①中加入Na2SO3的作用是____________。
(3)写出步骤②证明PbCO3沉淀已经洗涤干净的实验操作方法:_______________。
(4)若用NH4HCO3和NH3·H2O为脱硫转化剂,也可对上述流程中的含铅渣泥进行处理。如图是NH4 HCO3和NH3.H2O用量对含铅渣泥中脱硫率的影响:
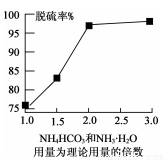
从图形可以看出,应选择NH4HCO3和NH3·H2O用量为理论用量的__________倍。该条件下步骤③从母液可获得副产品为_______________ 。
(5)步骤④使用纯铅和粗铅作电极,PbSiF6作电解质,可进行粗铅精炼。则阳极的电极材料是_________,阴极的电极反应式为__________________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省海宁市三校高二下学期期中化学试卷(解析版) 题型:选择题
用压强传感器探究生铁在pH=2和p H=4醋酸溶液中发生腐蚀的装置及得到的图像如下:
H=4醋酸溶液中发生腐蚀的装置及得到的图像如下:
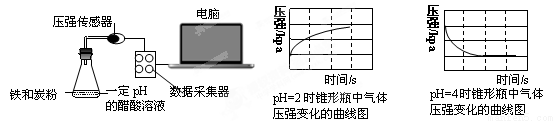
分析图像,以下结论错误的是
A.溶液pH≤2时,生铁发生析氢腐蚀
B.生铁的腐蚀中化学腐蚀比电化学腐蚀更普遍
C.在酸性溶液中生铁可能发生吸氧腐蚀
D.两溶液中负极反应均为:Fe – 2e-===Fe2+
查看答案和解析>>
科目:高中化学 来源:2015-2016学年贵州省高二上学期期中理化学试卷(解析版) 题型:简答题
判断题,下列表述中,正确的打“√”,错误的打“×”。
(1)实验室用大理石与稀盐酸反应制备二氧化碳,将大理石研成粉末,可加快化学反应速率( )
(2)将食物存放在电冰箱里,主要是为了隔绝空气,防止食物被氧化。( )
(3)1molN2与3molH2在高温高压、催化剂条件下反应,最终生成2mol的NH3 ( )
(4)化学反应的反应热只与反应体系的始态和终态有关 ,而与反应的途径无关。( )
,而与反应的途径无关。( )
(5)用K表示化学平衡常数,K值越大,正反应进行的程度越大,反应物转化率越大。( )
(6)1mol强酸与1mol强碱完全反应所放出的热量称为中和热。( )
查看答案和解析>>
科目:高中化学 来源:2015-2016学年贵州省高二上学期期中理化学试卷(解析版) 题型:选择题
四位同学同时进行反应:A(g)+3B(g)=2C(g)+2D(g) 速率测定实验,分别测得反应速率如下:
①v(A)=1.5mol/(L·min);②v(B)=0.6mol/(L·s)
③v(C)=0.4mol/(L·s);④v(D)=0.45mol/(L·s)。
其中,反应进行得最快的是 ( )
A.① B.② C.③ D.④
查看答案和解析>>
科目:高中化学 来源:2017届陕西省宝鸡市岐山县高三上期中化学试卷(解析版) 题型:实验题
硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量,并检验该补血剂是否变质。实验步骤如下:
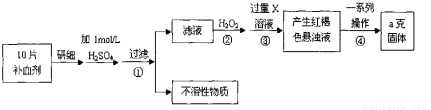
请回答下列问题:
(1) 步骤①滤液中滴加KSCN溶液后滤液变为红色,则该溶液中含有 (填离子符号),检验滤液中还存在Fe2+的方法为 (注明试剂、现象)。
(2) 步骤②加入过量H2O2的目的是 。
(3) 步骤③中反应的离子方程式为 。
(4) 步骤④中一系列处理的操作步骤包括:过滤、 、灼烧、 、称量。
(5) 若实验无损耗,则每片补血剂含铁元素的质量为 g。
查看答案和解析>>
科目:高中化学 来源:2017届陕西省宝鸡市岐山县高三上期中化学试卷(解析版) 题型:选择题
下列实验中,所选装置不合理的是
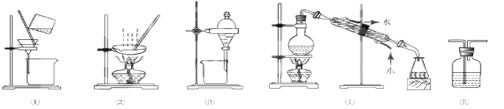
A.分离Na2CO3溶液和CH3COOC2H5,选④ B.粗盐提纯,选①和②
C.用FeC12溶液吸收C12,选⑤ D.用CC14提取碘水中的碘,选③
查看答案和解析>>
科目:高中化学 来源:2017届山西省协作体高三上期中化学试卷(解析版) 题型:填空题
硫化锌(ZnS)是一种重要的化工原料,难溶于水,可由炼锌的废渣锌灰制取t其工艺流程如下图所示。
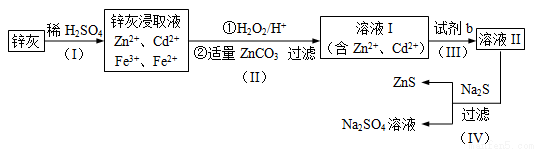
(1)为提高锌灰的浸取率,可采用的方法是____________(填序号)。
①研磨 ②多次浸取 ③升高温度 ④加 压 ⑤搅拌
压 ⑤搅拌
(2)步骤Ⅱ所得滤渣中的物质是_______________(写化学式)。
(3)步骤Ⅲ中可得Cd单质,为避免引入新的杂质,试剂b应为____________ 。
(4)步骤Ⅳ还可以回收Na2SO4来制取Na2S。
①检验ZnS固体是否洗涤干净的方法是______________,
②Na2S可由等物质的量的Na2S04和CH4在高温、催化剂条件下制取。化学反应方式为_________________;
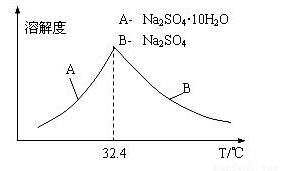
③已知Na2SO4.10H2O及Na2SO4的溶解度随温度变化曲线如图。从滤液中得到Na2SO4.10H2O的操作方法是________________________.
(5)若步骤Ⅱ加入的ZnCO3为b mol,步骤Ⅲ所得Cd为d mol,最后得到VL、物质的量浓度为c mol/L的Na2SO4溶液。则理论上所用锌灰中含有锌元素的质量为______________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省宣城市等四校高二上期中化学卷(解析版) 题型:选择题
在25℃时,某稀溶液中由水电离产生的c(OH-)=10-10mol/L。下列有关该溶液的叙述正确的是( )
A.该溶液一定呈酸性
B.该溶液中的c(H+)可能等于10-5
C.该溶液的pH可能为4,可能为10
D.该溶液有可能呈中性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com