
����Ŀ���ҹ��Ŵ��Ĵ���֮һ�ĺڻ�ҩ������Ƿۡ�����غ�ľ̿�۰�һ��������϶��ɵģ���ըʱ�ķ�ӦΪS + KNO3 + C��K2S + N2��+ CO2�������ݸ÷�Ӧ�ش��������⣺
(1)��д����ƽ��Ļ�ѧ����ʽ_____________________________________________��
(2)д���÷�Ӧ��������_____________����ԭ��______________��
(3)��˫���ŷ�����÷�Ӧ����ת�Ƶķ������Ŀ____________________________��
(4)���÷�Ӧ��48������ȫ��Ӧ����ת�Ƶ��ӵ����ʵ���Ϊ____________�������������������Ϊ__________��
(5)���÷�Ӧת����0.6mol���ӣ������ɵ������ڱ�״���µ����Ϊ___________�����������ƽ����Է�������Ϊ________________��
(6)�����ɵ���������������Ȼ�ԭ�����������12�ˣ���ת�Ƶ��ӵ����ʵ���Ϊ____________���μӷ�Ӧ��̼������Ϊ_____________��
���𰸡�S + 2KNO3 + 3C��K2S + N2��+ 3CO2�� S��KNO3 C 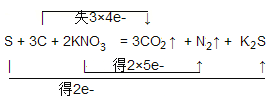 18mol 198g 4.48L 40 24mol 72 g
18mol 198g 4.48L 40 24mol 72 g
��������
(1)��ӦS + KNO3 + C��K2S + N2��+ CO2���У�SԪ�صĻ��ϼ۽���0�۱仯Ϊ-2�ۣ�NԪ�صĻ��ϼ۽���+5�۱仯Ϊ0�ۣ�CԪ�صĻ��ϼ�����0�۱仯Ϊ+4�ۣ�����ת������12e-����ϵ����غ���ƽ��д��ѧ����ʽΪ��S+2KNO3+3C�TK2S+N2��+3CO2����
(2)��ӦS+2KNO3+3C�TK2S+N2��+3CO2���У�N��SԪ�ػ��ϼ۽��ͣ�����ԭ����KNO3����Ϊ��������CԪ�ػ��ϼ����ߣ���������CΪ��ԭ����
(3)�÷�Ӧ��ת�Ƶ�������Ϊ12e������ת�Ƶĵ��ӷ������ĿΪ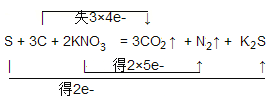 ��
��
(4) �ɷ�ӦS+2KNO3+3C�TK2S+N2��+3CO2����֪�����÷�Ӧ��48����1.5mol��ȫ��Ӧ����ת�Ƶ��ӵ����ʵ���Ϊ1.5mol��12=18mol��������������CO2������Ϊ1.5mol��3��44g/mol=198g��
(5) �ɷ�ӦS+2KNO3+3C�TK2S+N2��+3CO2����֪��Ӧ��ת�Ƶ�������Ϊ12e�������÷�Ӧת����0.6mol���ӣ������ɵ������ڱ�״���µ����Ϊ![]() �����������ƽ����Է�������Ϊ
�����������ƽ����Է�������Ϊ![]() ��
��
(6) S+2KNO3+3C�TK2S+N2��+3CO2�� �������� ��ԭ���� ������ ת�Ƶ���
36 110 28 132 138 132 6 12 e��
72g 12g 24mol
�����ɵ���������CO2�������Ȼ�ԭ����K2S����������12�ˣ���ת�Ƶ��ӵ����ʵ���Ϊ24mol���μӷ�Ӧ��̼������Ϊ72g��


 �п�������㾫��ϵ�д�
�п�������㾫��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ��������KClO3��I2����ʽ��Ӧ��2KClO3��I2=2KIO3��Cl2 �� �������ƶ���ȷ����( )
A.I2������ԭ��Ӧ
B.������ΪI2
C.��ԭ��ΪKClO3
D.��Ӧ��KClO3����ԭΪCl2 �� I2������ΪKIO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧʽ����ʵ��ʾ���ʷ�����ɵ���
A. NaOH B. SO3 C. CsCl D. SiO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���У���ȷ����( )
A.��������������ԭ��������������
B.���������ڷ�Ӧ�еõ�����(����Ӷ�ƫ��)������
C.��ԭ���ڷ�Ӧʱ����Ԫ�صĻ��ϼ۽���
D.��һ����Ӧ�У��������ͻ�ԭ����������ͬһ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʻ�Ϊͬ���칹�����( )
A.���ۺ���ά��B.�Ҵ�������C.���������Ͷ���D.ʯī��C60
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������ơ���װ��ʹ�÷�������ѧ��ѧʵ��Ļ�����������ͼ��ʾʵ��װ�ã��ش��������⡣
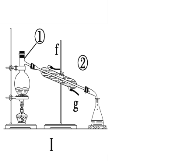
��1��д����ͼ�����������ƣ���____________����_____________��
��2��������װ�â����ƾ���ˮ�Ļ�����ȱ�ٵ�����___________�����н�ˮ����________(�f����g��)��
��3������ʵ����Ҫ������װ���н��У�����ţ���
a���Ӻ�ˮ����ȡ����ˮ��______�� b�������Ȼ��ƺ�ˮ��______��
c������̼��ƺ�ˮ��______�� d������ֲ���ͺ�ˮ��______��
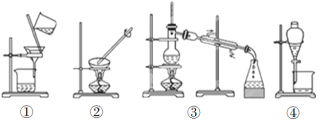
��4��װ�â��в�������������__________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���У���ȷ����
A.SO2��ʹFeCl3������KMnO4��Һ��ɫ����ɫB.�����ó���ʯ��ˮ������SO2��CO2
C.�ɽ�SO2ͨ���ܸߵ��̴��ŷŵ�������D.����SO2ͨ��Ũ��CaCl2��Һ�п������ɰ�ɫ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йر�����ϩ��˵����ȷ����
A.��������ˮB.��ϩ��һ�������¿ɷ����Ӿ۷�Ӧ
C.����ʹ���Ը��������Һ��ɫD.�������д���̼̼˫��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧ�仯�У��������ȷ�Ӧ���ǣ� ��
A.����ˮ��ӦB.�������������ᷴӦ
C.������������ӦD.̼������ȷֽ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com