
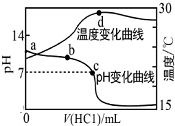
 室温下,向a点(pH=a)的20.00mL 1.000mol•L-1氨水中滴入1.000mol•L-1盐酸,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法错误的是( )
室温下,向a点(pH=a)的20.00mL 1.000mol•L-1氨水中滴入1.000mol•L-1盐酸,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法错误的是( )| A. | 将此氨水稀释,溶液的导电能力减弱 | |
| B. | b点溶液中离子浓度大小可能存在:c(NH${\;}_{4}^{+}$)>c(Cl-)>c(OH-)>c(H+) | |
| C. | c点时消耗盐酸体积V(HCl)<20.00mL | |
| D. | a、d两点的溶液,水的离子积Kw(a)>Kw(d) |
分析 A.稀释后溶液中离子浓度减小,则溶液导电性减弱;
B.b点溶液呈碱性,则c(OH-)>c(H+),结合电荷守恒判断;
C.盐酸与一水合氨恰好中和时溶液显酸性;
D.温度越高水的离子积越大.
解答 解:A.将此氨水稀释,溶液中离子浓度减小,则溶液的导电能力减弱,故A正确;
B.b点溶液呈碱性,则c(OH-)>c(H+),根据电荷守恒可知:c(NH4+)>c(Cl-),若加入盐酸较多时,则溶液中满足:c(NH4+)>c(Cl-)>c(OH-)>c(H+),故B正确;
C.溶液显中性时,盐酸物质的量小于一水合氨,所以c点消耗盐酸体积V(HCl)<20.00mL,故C正确;
D.d点温度高于a点,水的离子积Kw(a)<Kw(d),故D错误;
故选D.
点评 本题考查水溶液中的电离平衡以及酸碱中和滴定,明确滴定曲线中各点的pH是解答的关键,注意学会利用弱电解质的电离、盐类水解原理分析解答.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,33.6L氟化氢中含有氟原子的数目为1.5NA | |
| B. | 3mol铁与足量的水蒸气充分反应,转移8NA个电子 | |
| C. | 50mL18.4mol•L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA | |
| D. | 某密闭容器盛有0.1molN2和0.3molH2,在一定条件下充分反应,转移电子的数目为0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水中的钢闸门连接电源的负极 | |
| B. | 地下钢管连接锌板 | |
| C. | 铁件镀铜 | |
| D. | 自行车的钢圈和车铃上镀上一层铬,既耐腐蚀又美观耐磨 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有Cu生成的一极是阴极,发生氧化反应 | |
| B. | 反应中转移电子的物质的量为0.4 mol | |
| C. | 在另一极得到O2的体积(标准状况)是1.12 L | |
| D. | 电解一段时间后,溶液的pH不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气可以使湿润的有色布条褪色,是因为氯气具有漂白性 | |
| B. | SO2溶于水,其水溶液能导电,说明SO2是电解质 | |
| C. | 油脂制肥皂实验中加乙醇的目的是增大油脂的溶解度从而增大与氢氧化溶液的接触面积,从而加快油脂皂化反应速率 | |
| D. | 某溶液用硝酸酸化无现象,再滴加氯化钡溶液有白色沉淀产生,说明溶液中有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
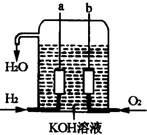 宇宙飞船上使用的氢氧燃料电池是一种新型化学电池,其构造如图所示,A、B是多孔性炭制成的两个电极,通入的气体由孔隙中逸出,并在电极表面放电.
宇宙飞船上使用的氢氧燃料电池是一种新型化学电池,其构造如图所示,A、B是多孔性炭制成的两个电极,通入的气体由孔隙中逸出,并在电极表面放电.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
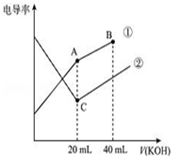 电导率是衡量电解质溶液导电能力大小的物理量,据溶液电导率变化可以确定滴定反应的终点.如图是某同学用0.1mol/L KOH溶液分别滴定体积均为20mL、浓度均为0.1mol/L的HCl和CH3COOH溶液滴定曲线示意图(混合溶液体积变化忽略不计).下列有关判断不正确的是( )
电导率是衡量电解质溶液导电能力大小的物理量,据溶液电导率变化可以确定滴定反应的终点.如图是某同学用0.1mol/L KOH溶液分别滴定体积均为20mL、浓度均为0.1mol/L的HCl和CH3COOH溶液滴定曲线示意图(混合溶液体积变化忽略不计).下列有关判断不正确的是( )| A. | 曲线①代表0.1 mol/L KOH溶液滴定CH3COOH溶液的滴定曲线,曲线②代表0.1 mol/L KOH溶液滴定HCl溶液的滴定曲线 | |
| B. | 在相同温度下,C点水电离的c(H+)小于A点水电离的 c(H+) | |
| C. | 在A点的溶液中有:c(CH3COO-)+c(OH-)-c(H+)=0.1 mol/L | |
| D. | 在B点的溶液中有:c(K+)>c(OH-)>c(CH3COO-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
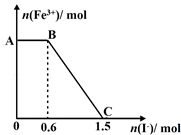 已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+,现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列说法中不正确的是( )
已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+,现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列说法中不正确的是( )| A. | 图中AB段的氧化剂为K2Cr2O7 | |
| B. | 图中BC段发生的反应为2Fe3++2I-═2Fe2++I2 | |
| C. | 开始加入的K2Cr2O7为0.25 mol | |
| D. | 共有1molFeSO4被氧化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com