
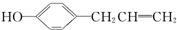
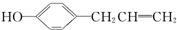 +NaOH→
+NaOH→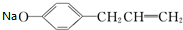 +H2O;
+H2O;分析 (1)该分子中含有碳碳双键和酚羟基,苯环上酚羟基邻对位氢原子和碳碳双键能和溴发生反应,碳碳双键和苯环能和氢气发生加成反应;
(2)该物质和NaOH发生中和反应生成盐和水;
(3)苯环上所有碳原子共面、碳碳双键两端的碳原子共面.
解答 解:(1)该分子中含有碳碳双键和酚羟基,苯环上酚羟基邻对位氢原子和碳碳双键能和溴发生反应,所以1mol该物质最多能和2mol溴发生取代反应、1mol溴发生加成反应,所以最多需要3mol溴,碳碳双键和苯环能和氢气发生加成反应,最多需要4mol氢气,故答案为:3;4;
(2)该物质和NaOH发生中和反应生成盐和水,反应方程式为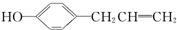 +NaOH→
+NaOH→ +H2O,
+H2O,
故答案为: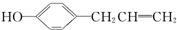 +NaOH→
+NaOH→ +H2O;
+H2O;
(3)苯环上所有碳原子共面、碳碳双键两端的碳原子共面,碳碳单键能发生旋转,所以胡椒酚中最少有7个碳原子共平面,最多有9个碳原子共平面,故答案为:7;9.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,难点是(3)题原子共面判断,以苯、乙烯为例采用知识迁移的方法判断,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
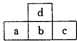 如图是短周期元素的一部分,若a原子最外层电子数比次外层少了3个,则下列说法不正确的是( )
如图是短周期元素的一部分,若a原子最外层电子数比次外层少了3个,则下列说法不正确的是( )| A. | a、b、c的最高价氧化物对应水化物的酸性强弱关系为c>b>a | |
| B. | d的氢化物比b的氢化物稳定 | |
| C. | 非金属性:c>b>a | |
| D. | 原子半径:c>b>a>d |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2、NH3、HCl | B. | O2、NO、NO2 | C. | O2、H2、N2 | D. | CO2、H2、SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  的名称为2-乙基丙烷 的名称为2-乙基丙烷 | |
| B. | CH2═CHCH3不能发生取代反应 | |
| C. | 新戊烷与Br2发生一取代生成两种有机物 | |
| D. | 2-甲基-1,3-丁二烯与等物质的量的Br2发生加成反应的产物有3种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com