
向m g镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体b L.向反应后的溶液中加入c mol/L氢氧化钾溶液V mL,使金属离子刚好沉淀完全,得到的沉淀质量为n g.再将得到的沉淀灼烧至质量不再改变为止,得到固体p g.则下列关系不正确的是( )
|
| A. |
| B. |
| C. | n=m+17Vc | D. |
|
考点:
镁、铝的重要化合物;有关混合物反应的计算.
专题:
压轴题;几种重要的金属及其化合物.
分析:
根据题意利用反应过程中的变化进行分析计算,镁和铝的混合物中加入适量的稀硫酸全部反应生成氢气b L,和氯化镁和氯化铝;向反应后的溶液中加入c mol/L氢氧化钾溶液V mL使金属离子刚好沉淀完全,得到的沉淀为氢氧化镁和氢氧化铝,质量为ng,固体灼烧得到氧化镁和氧化铝质量为pg,结合各步反应进行计算判断;
解答:
解:反应化学方程式为;Mg+H2SO4=MgSO4+H2↑;2Al+3H2SO4=Al2(SO4)3+3H2↑;MgSO4+2KOH=Mg(OH)2↓+K2SO4;
Al2(SO4)3+6KOH=2Al(OH)3↓+3K2SO4;Mg(OH)2 MgO+H2O;
MgO+H2O;
2Al(OH)3 Al2O3+3H2O;根据化学方程式可得:
Al2O3+3H2O;根据化学方程式可得:
A、根据化学方程式的定量关系,生成的氢气的物质的量等于参加反应的碱的物质的量的一半,即b=22.4L/mol×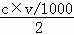 ,整理得c=
,整理得c=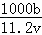 ,所以A项正确;
,所以A项正确;
B、选项中p为生成的氧化物的质量,1molMg可结合1molO,2molAl结合3molO,因此生成沉淀的物质的质量等于镁和铝的质量之和加氧元素的质量,而结合氧元素的物质的量等于生成氢气的物质的量,也等于消耗氢氧根离子的物质的量的一半,即p=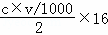 +m=m+
+m=m+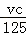 所以B项正确;
所以B项正确;
C、得到的氢氧化镁和氢氧化铝的质量等于镁铝的质量和与氢氧根离子的质量之和,即n=m+c×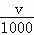 ×17=m+
×17=m+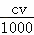 ×17,选项中忽略了体积的单位,故C错误;
×17,选项中忽略了体积的单位,故C错误;
D、氧化镁和氧化铝的质量可以按照极值方法计算,若mg全是镁,得到的氧化物为氧化镁,根据元素守恒,则质量为P=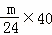 =
=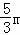 ;若mg全是铝,得到的氧化物为氧化铝,根据元素守恒,则质量为p=
;若mg全是铝,得到的氧化物为氧化铝,根据元素守恒,则质量为p=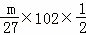 =
=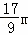 ;质量介于二者之间,故D正确;
;质量介于二者之间,故D正确;
故选C.
点评:
本题综合考查镁铝元素化合物知识,以及相关化学计算.


 一课一练课时达标系列答案
一课一练课时达标系列答案 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:
在一定温度、压强下,向100mLCH4和Ar的混合气体中通入400mLO2,点燃使其完全燃烧,最后在相同条件下得到干燥气体460mL,则反应前混合气体中CH4和Ar物质的量之比是( )
|
| A. | 1:4 | B. | 1:3 | C. | 1:2 | D. | 1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知下列几种化学键的键能:
化学键 Si﹣Si键 H﹣H键 Cl﹣Cl键 H﹣Cl键 Si﹣Cl键
键能(KJ/mol) 176 436 243 431 360
请计算下列反应的反应热:
(1)H2(g)+Cl2(g)=2HCl(g)△H= ;
(2)50mL 0.50mol•L﹣1盐酸与50mL 0.55mol/L NaOH溶液简易量热计中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
(a)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大”“偏小”“无影响”).
(b)酸、碱混合时,把量筒中的NaOH溶液缓缓倒入小烧杯中测得的中和热的数值会 .(填“偏大”“偏小”“无影响”)
(c) 实验中用环形铜丝搅拌棒代替 ,测得的中和热的数值会 .(均填“偏大”“偏小”“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作中错误的是( )
|
| A. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
|
| B. | 蒸馏操作时,应使温度计水银球上端与蒸馏烧瓶的支管口下端相平 |
|
| C. | 蒸发操作时,应残留少许液体,停止加热,再利用余热使水分完全蒸干 |
|
| D. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在硫酸铝、硫酸钾和明矾的混合溶液中,SO42﹣的浓度为0.4mol/L,当加入等体积0.4mol/L KOH溶液时,生成的沉淀恰好完全溶解.则反应后溶液中K+的浓度约为( )
|
| A. | 0.225mol/L | B. | 0.25mol/L | C. | 0.45mol/L | D. | 0.9mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
图1为一定量AlCl3溶液中加入NaOH溶液后,产生Al(OH)3白色沉淀的质量与NaOH的物质的量之间的关系曲线.试回答:
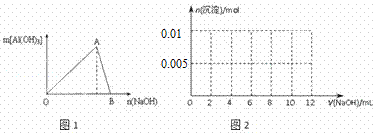
Ⅰ.A点时已参加反应的AlCl3和NaOH的物质的量之比为1比 ;
Ⅱ.B处溶液中存在的浓度最大的离子是 (填离子符号);向B处生成的溶液中通入过量的二氧化碳,可见到的现象是(用离子方程式来表示) ;
Ⅲ.铝铵矾是一种复盐,其主要化学成分为十二水硫酸铝铵NH4Al(SO4)2.12H2O,向该盐的浓溶液中逐滴加入浓NaOH溶液,将发生一系列变化,已知NH4+与AlO2﹣在水溶液中不能大量共存,会发生如下反应:
NH4++AlO2﹣+H2O=Al(OH)3↓+NH3↑.试回答:
(1)写出硫酸铝铵在水溶液中电离的方程式: ;
(2)在逐滴加入NaOH溶液的过程中,产生的现象有:
①溶液中出现白色沉淀;②有刺激性气味的气体放出;③白色沉淀量逐渐增多;④白色沉淀完全消失:⑤白色沉淀逐渐减少.请排出以上各种现象由先到后出现的正确顺序(用序号答) ;
(3)向含有0.1mol NH4Al(SO4)2溶液中逐滴加入5mol•L﹣1NaOH溶液,请在图2中画出生成沉淀的物质的量与加入NaOH溶液体积的关系示意图.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列电离方程式书写正确的是()
A. Al2(SO4)3═Al23++3SO42﹣ B. NaHSO4═Na++HSO4﹣
C. NaHCO3═Na++H++CO32﹣ D. Na3PO4═3Na++PO43﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液的溶质可能由下列离子组成:Cl﹣、SO42﹣、CO32﹣、H+、Ba2+、Na+,某同学进行了如下实验:
(1)向溶液中加入过量的BaCl2溶液,有白色沉淀产生,过滤;
(2)向(1)中滤液里加入AgNO3溶液,有白色沉淀产生;
(3)将足量稀盐酸加入(1)的沉淀中,沉淀部分消失,有气体产生.
依据以上实验回答下列问题;
(1)原溶液中一定含有 ;
(2)一定没有 ;
(3)可能含有 ;如果要确定原溶液中是否存在该离子,应选用试剂是 ;
A.稀HNO3 B.Ba(NO3)2 C.AgNO3 D.Na2CO3
(4)写出(3)中沉淀消失的离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
某元素X的气态氢化物在高温下分解为固态的X单质和H2,分解反应前后气体的质量之比是17:1.下列有关叙述中错误的是()
A. X的阴离子的电子排布式是1s22s22p63s23p6
B. X的最高价氧化物对应的水化物的酸性比砷酸强
C. X的最高价氧化物中,X的质量分数为50%
D. X的气态氢化物的水溶液呈酸性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com