
| 1.12L |
| 22.4L/mol |
| y |
| 2 |
| 1.12L |
| 22.4L/mol |
| y |
| 2 |
| 点燃 |
| 点燃 |


 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | FeSO4.7H2O | (NH4)2SO4 | (NH4)2SO4.FeSO4.6H2O |
| 10 | 20.0 | 73.0 | 17.2 |
| 20 | 26.5 | 75.4 | 21.6 |
| 30 | 32.9 | 78.0 | 28.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碘水不可用于鉴别苯、四氯化碳、乙醇三种无色液体 |
| B、氢气还原氧化铜实验先加热再通氢气 |
| C、配制一定物质的量浓度的硫酸溶液时.只需使用1次玻璃棒 |
| D、欲从碘水中分离出I2,可将适量的CCl4加入碘水中振荡静置分层后分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、FeS2
| ||||||||
B、FeS2
| ||||||||
C、FeS2
| ||||||||
D、FeS2
|
查看答案和解析>>
科目:高中化学 来源: 题型:
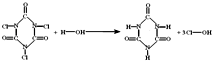
| A、分子中含有离子键和共价键 |
| B、产物HClO中Cl的化合价为+1价 |
| C、分子中C-N的键长小于C=O的键长 |
| D、上述反应属于氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、油脂在空气中完全燃烧转化为水和二氧化碳 |
| B、浓硝酸、浓硫酸均能将木炭氧化成二氧化碳 |
| C、Na、C、S都能直接与氧气反应,生成两种相应的氧化物 |
| D、蔗糖、麦芽糖的分子式都是C12H22O11,二者互为同分异构体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com