
 HA和HB两种酸的溶液分别加水稀释时,pH变化的简图如图所示,下列叙述中不正确的是( )
HA和HB两种酸的溶液分别加水稀释时,pH变化的简图如图所示,下列叙述中不正确的是( )| A、HA是一种强酸 |
| B、x点,[A-]=[B-] |
| C、HB是一种弱酸 |
| D、原溶液中HA的物质的量浓度为HB的10倍 |


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:
A、N2的电子式: |
| B、质子数为53、中子数为78的碘原子:131I |
| C、HClO的结构简式:H-Cl-O |
D、S2-的结构示意图: |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 |
B、 |
C、 |
D、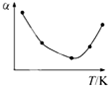 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③ | B、①③⑤ |
| C、②③⑤ | D、②④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2O与Na2O2都能和水反应生成碱,它们都是碱性氧化物 |
| B、Na2O2中氧元素的化合价为-2价 |
| C、Na2O与CO2发生化合反应生成Na2CO3,Na2O2与CO2发生置换反应生成O2 |
| D、Na2O2需要密封保存 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 用如图表示的一些物质或概念间的从属关系中不正确的是( )
用如图表示的一些物质或概念间的从属关系中不正确的是( )| X | Y | Z | |
| A | 质子 | 原子核 | 原子 |
| B | 胶体 | 分散系 | 混合物 |
| C | 电解质 | 离子化合物 | 化合物 |
| D | 氧化物 | 化合物 | 纯净物 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、干冰升华 |
| B、CaCO3(s)分解为CaO(s)和CO2(g) |
| C、NH3(g)与HCl(g)反应生成NH4Cl(s) |
| D、氯化钠溶于水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定.偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构示意图如图所示,它的化学式是
在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定.偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构示意图如图所示,它的化学式是查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com