
| A�� | �õ�ص�����Ϊп | |
| B�� | �õ�ط�Ӧ�ж���������������� | |
| C�� | �� 0��lmol Zn ��ȫ�ܽ�ʱ���������Һ�ĵ��Ӹ���Ϊ 1.204��l023 | |
| D�� | ���������ӦʽΪ��2MnO2+2eһ+2H2O�T2MnO ��OH��+2OH- |
���� �ɵ���ܷ�ӦZn+2MnO2+H2O�TZnO+2MnO��OH����֪��Zn��������Ϊԭ��صĸ������缫��ӦΪZn-2e-+2OH-�TZnO+H2O��MnO2����ԭ��Ϊԭ��ص��������缫��ӦΪMnO2+H2O+e-�TMnO��OH��+OH-��
��� �⣺A���ӵ�ط�Ӧ��֪��п��������ʧȥ���ӣ������Ǹ�������A����
B���õ�ط�Ӧ�ж������̷����˻�ԭ��Ӧ���������̵õ����ӣ�����ԭ��Ϊԭ��ص���������B����
C������0.1molп�ܽ�ʱ��ʧȥ������Ϊ0.1��2��6.02��1023=1.204��1023���������ɸ��������·�������������������Һ����C����
D����ص�������ӦʽΪMnO2+H2O+e-�TMnO��OH��+OH-����2MnO2+2e-+2H2O�T2MnO��OH��+2OH-����D��ȷ��
��ѡ��D��
���� ���⿼�����ͻ�ѧ��Դ�������ڵ缫��Ӧ����ʽ�Ŀ��飬��Ŀ�Ѷ��еȣ�ע��������������ı仯����ϵ���ʵ��ص���д�缫��Ӧʽ�������״���ΪC��ע���������Һ�����ӵ��ƶ�������


 �����������һ��һ��ϵ�д�
�����������һ��һ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����ϡ���������ɫ���壬������ͨ�����ʯ��ˮ�У���Һ����ǣ�һ����CO32- | |
| B�� | �����Ȼ�����Һ�а�ɫ�����������ټ����ᣬ��������ʧ��һ����SO42- | |
| C�� | ��������������Һ�����ȣ�������������ʹʪ���ɫʯ����ֽ������һ����NH4+ | |
| D�� | ij��Һ�м�����������Һ��������ɫ����������Һ��һ������Cl- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
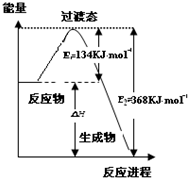 �о�NO2��SO2��CO�ȴ�����Ⱦ����Ĵ���������Ҫ���壮
�о�NO2��SO2��CO�ȴ�����Ⱦ����Ĵ���������Ҫ���壮�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
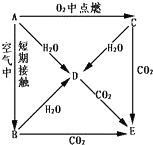 A��B��C��D��E�������ʶ�����Ԫ�أ����ǰ�ͼ��ʾ��ϵ�ת������֪A Ϊ���ʣ�
A��B��C��D��E�������ʶ�����Ԫ�أ����ǰ�ͼ��ʾ��ϵ�ת������֪A Ϊ���ʣ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��λʱ����2amol A���ɣ�ͬʱ����3amol B | |
| B�� | A��B��C��Ũ�Ȳ��ٱ仯 | |
| C�� | ����������ѹǿ���ٱ仯 | |
| D�� | A��B��C�ķ�����Ŀ��Ϊ1��3��2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
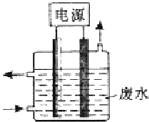 ��ͼ��ʾװ�ó�ȥ����CN-��Cl-��ˮ�е�CN-ʱ��������Һ��PHֵΪ9��10������������ClO-��CN-����Ϊ��������Ⱦ�����壬����˵������ȷ���ǣ�������
��ͼ��ʾװ�ó�ȥ����CN-��Cl-��ˮ�е�CN-ʱ��������Һ��PHֵΪ9��10������������ClO-��CN-����Ϊ��������Ⱦ�����壬����˵������ȷ���ǣ�������| A�� | ��ʯī���������������� | |
| B�� | �����ĵ缫��ӦʽΪ��Cl-+2OH--2e-�TClO-+H2O | |
| C�� | ��������������ǿ�������������Լ��� | |
| D�� | ��ȥCN-�ķ�Ӧ��5ClO-+2CN-+2H+�TN2��+2CO2��+5Cl-+H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
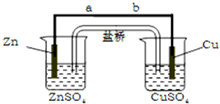
| A�� | ��������������һֱ���ֺ��� | |
| B�� | ����Ϊ������Ag2S���������ɵ����� | |
| C�� | �ù������ܷ�ӦΪ2Al+3Ag2S�T6Ag+Al2S3 | |
| D�� | ��ɫ��ȥ��ԭ���Ǻ�ɫAg2Sת��Ϊ��ɫAg |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 11.2 g FeͶ�뵽400 mL 1 mol/L�������г�ַ�Ӧ��ת�Ƶ�������Ϊ0.2 NA | |
| B�� | ��״���£�11.2 L C2H6��3 NA��C-H���Թ��ۼ� | |
| C�� | ��״���£�5.6 L NO��5.6 L O2��Ϻ�ķ�������Ϊ0.5 NA | |
| D�� | ��״���£���������������Һ��Ӧ����1 mol����ʱ��ת�Ƶĵ�����ΪNA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com