
把0.02mol/LCH3COOH溶液和0.01mol/LNaOH溶液等体积混合,则混合溶液中微粒浓度关系正确的是( )
A.C(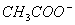 )>C(Na+)
)>C(Na+)
B.C(CH3COOH)>C(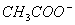 )
)
C.2C(H+)=C(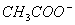 )-C(CH3COOH)
)-C(CH3COOH)
D.C(CH3COOH)+ C(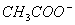 )=0.01mol/L
)=0.01mol/L
科目:高中化学 来源: 题型:
下列说法正确的是 ( )
A、水的离子积KW只与温度有关,但外加酸、碱、盐一定会影响水的电离程度
B、Ksp不仅与难溶电解质的性质和温度有关,还与溶液中相关离子的浓度有关
C、常温下,在0.10 mol·L-1的NH3·H2O溶液中加入少量NH4C1晶体,能使溶液的pH
减小,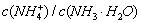 的比值增大
的比值增大
D、室温下,CH3COOH的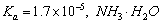 的
的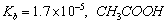 溶液中的c (H+)与NH3·H2O中的c(OH-)相等
溶液中的c (H+)与NH3·H2O中的c(OH-)相等
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)向NaHSO4溶液中,逐滴加入Ba(OH)2溶液中至中性,请写出发生反应的离子方程式: 。
(2)在以上中性溶液中,继续滴加Ba(OH)2溶液,请写出此步反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
水体中重金属铅的污染问题备受关注。水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH)3-、Pb(OH)42-,各形态的浓度分数α随溶液pH变化的关系如图所示:
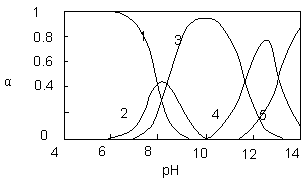
【1表示Pb2+,2表示Pb(OH)+,3表示Pb(OH)2,4表示Pb(OH)3-,5表示Pb(OH)42-】
⑴Pb(NO3)2溶液中,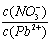 2 (填“>”、“=”、“<”);往该溶液中滴入氯化铵溶液后,
2 (填“>”、“=”、“<”);往该溶液中滴入氯化铵溶液后,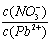 增加,可能的原因是 。
增加,可能的原因是 。
⑵往Pb(NO3)2溶液中滴稀NaOH溶液,pH=8时溶液中存在的阳离子(Na+除外)有
,pH=9时,主要反应的离子方程式为 。
⑶某课题组制备了一种新型脱铅剂,能有效去除水中的痕量铅,实验结果如下表:
 |
 离子 Pb2+ Ca2+ Fe3+ Mn2+ Cl-
离子 Pb2+ Ca2+ Fe3+ Mn2+ Cl-
处理前浓度/(mg·L-1) 0.20130 29.8 0.120 0.087 51.9
处理后浓度/(mg·L-1) 0.004 22.6 0.040 0.053 49.8
 上表中除Pb2+外,该脱铅剂对其它离子的去除效果最好的是 。
上表中除Pb2+外,该脱铅剂对其它离子的去除效果最好的是 。
⑷如果该脱铅剂(用EH表示)脱铅过程中主要发生的反应为:
2EH(s)+Pb2+ E2Pb(s)+2H+
E2Pb(s)+2H+
则脱铅的最合适pH范围为 (填代号)。
A.4~5 B.6~7 C.9~2013 D.2013~12
查看答案和解析>>
科目:高中化学 来源: 题型:
醋酸溶液中存在电离平衡:
CH3COOH H++CH3COO-,下列叙述不正确的是 ( )
H++CH3COO-,下列叙述不正确的是 ( )
A.醋酸溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-)
B.0.12mol/L的CH3COOH溶液加水稀释,溶液中c(OH-)减小
C.CH3COOH溶液中加入少量的CH3COONa固体,平衡逆向移动
D.常温下,pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<7
查看答案和解析>>
科目:高中化学 来源: 题型:
向体积为0.05mol·L-1CH3COOH溶液中加入体积为Vb的0.05mol·L-1KOH溶液,下列关系错误的是
A. Va>Vb时:c (CH3COOH) +c (CH3COO-)>c (K+)
B. Va=Vb时:c (CH3COOH) +c (H+)>c (OH-)
C. Va<Vb时:c (CH3COO-)>c (K+)> c (OH-)> c (H)
D. Va与Vb任意比时:c (K+)+ c (H+) =c (OH-)+ c (CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
在下列叙述中,能说明盐酸是强酸,醋酸是弱酸的是
A.将pH=4的盐酸和醋酸稀释成pH=5的溶液,醋酸所需加入的水量多
B.盐酸和醋酸都可用相应的钠盐与浓硫酸反应制取
C.相同pH值的盐酸和醋酸溶液中分别加入相应的钠盐固体,醋酸的pH值变化大
D.相同pH值的盐酸和醋酸分别跟锌反应时,产生氢气的起始速度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
用酚酞、石蕊、0.1mol/L氨水、氯化铵晶体、0.1mol/L盐酸、熟石灰和蒸馏水,若仅用
上述试剂怎样用简单实验方法证明氨水是弱碱?并指出是通过什么途径证明氨水是弱碱的?
查看答案和解析>>
科目:高中化学 来源: 题型:
I.在温度为T时,向2.0 L恒容密闭容器中充入1.0 mol A和1.0 mol B,发生反应A(g)+B(g)  C(g),一段时间后达到平衡。测定得部分数据见下表:
C(g),一段时间后达到平衡。测定得部分数据见下表:
| t/s | 0 | 5 | 15 | 25 | 35 |
| n(A)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
回答下列问题:
(1)反应前5 s的平均反应速率v(A) =____________
(2)温度为T时,该反应的化学平衡常数=
(3)升高温度,平衡时c(A)=0.41 mol·L-1,则反应的ΔH (填 “>0” 或 “<0”)
(4)相同温度下,起始时向容器中充入0.2 mol A、0.2 mol B和1.0 mol C,反应达到平衡前,反应速率v正 v逆(填“>” 或 “<”)
(5)下列措施能增大反应速率,且平衡往正反应方向移动是 。
a.及时分离出A气体 b.适当升高温度
c.增大B的浓度 d.选择高效催化剂
II.NO、NO2是常见的氧化物。用H2或CO催化还原NO可达到消除污染的目的。
已知:2NO(g) = N2(g) + O2(g) △H = -180.5kJ·mol-1
2H2O(l) = 2H2(g) + O2(g) △H = +571.6kJ·mol-1
则用H2催化还原NO消除污染的热化学方程式是
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com