
【题目】氢气是一种清洁高效能源,以甲醇为原料可以制取氢气。回答下列问题:
(1)甲醇水蒸气重整制氢
主反应:①CH3OH(g)![]() CO(g)+2H2(g) ΔH =+90.7kJ/mol
CO(g)+2H2(g) ΔH =+90.7kJ/mol
②CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH =-41.2 kJ/mol
CO2(g)+H2(g) ΔH =-41.2 kJ/mol
副反应:③CO(g)+3H2(g)![]() CH4(g)+H2O(g) ΔH =+206.3 kJ/mol
CH4(g)+H2O(g) ΔH =+206.3 kJ/mol
则甲醇水蒸气重整制氢反应(反应Ⅰ):CH3OH(g) +H2O(g)![]() CO2(g)+3H2(g)的 ΔH=_________。反应②中lmolCO与lmol水蒸气反应的的活化能为E1kJ,则该反应生成物的活化能为_________kJ。
CO2(g)+3H2(g)的 ΔH=_________。反应②中lmolCO与lmol水蒸气反应的的活化能为E1kJ,则该反应生成物的活化能为_________kJ。
(2)实验室模拟甲醇水蒸气重整制氢过程,合成器组成n(CH3OH):n(H2O) =1:1时,体系中甲醇的平衡转化率与温度和压强的关系如图所示。
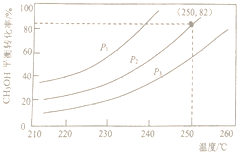
①该反应的平衡常数表达式为_______________。
②当温度为250℃、压强为P2时,反应达平衡时H2的体积分数为______________。
③图中的压强由小到大的顺序是________________。
④根据主副反应分析,氢气的产率随压强的增大而___________,其原因是__________________。
(3)MFC30氢氧燃料电池是以碳酸盐为电解质(提供CO32-)的高温型燃料电池,负极的电极反应式为_____。
【答案】 +49.5kJ/mol E1+41.2 K=![]() 67.6%或0.676或0.68 P1<P2<P3 减少 随着压强增大,反应①逆向移动,反应②不移动,副反应③正向移动,导致氢气的产率下降 H2-2e-+CO32-=H2O+CO2
67.6%或0.676或0.68 P1<P2<P3 减少 随着压强增大,反应①逆向移动,反应②不移动,副反应③正向移动,导致氢气的产率下降 H2-2e-+CO32-=H2O+CO2
【解析】(1)甲醇水蒸气重整制氢主反应有①CH3OH(g)![]() CO(g)+2H2(g) ΔH =+90.7kJ/mol
CO(g)+2H2(g) ΔH =+90.7kJ/mol
②CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH =-41.2 kJ/mol ,副反应有③CO(g)+3H2(g)
CO2(g)+H2(g) ΔH =-41.2 kJ/mol ,副反应有③CO(g)+3H2(g)![]() CH4(g)+H2O(g) ΔH =+206.3 kJ/mol 。由①+②得:CH3OH(g) +H2O(g)
CH4(g)+H2O(g) ΔH =+206.3 kJ/mol 。由①+②得:CH3OH(g) +H2O(g)![]() CO2(g)+3H2(g),则甲醇水蒸气重整制氢反应(反应Ⅰ):CH3OH(g) +H2O(g)
CO2(g)+3H2(g),则甲醇水蒸气重整制氢反应(反应Ⅰ):CH3OH(g) +H2O(g)![]() CO2(g)+3H2(g)的ΔH=+90.7kJ/mol-41.2 kJ/mol=+49.5kJ/mol 。反应②中lmolCO与lmol水蒸气反应的的活化能为E1kJ,因为lmolCO与lmol水蒸气反应后要放出41.2 kJ,这些热量等于生成物的活化能减去反应物的活化能,所以该反应生成物的活化能为E1+41.2kJ。
CO2(g)+3H2(g)的ΔH=+90.7kJ/mol-41.2 kJ/mol=+49.5kJ/mol 。反应②中lmolCO与lmol水蒸气反应的的活化能为E1kJ,因为lmolCO与lmol水蒸气反应后要放出41.2 kJ,这些热量等于生成物的活化能减去反应物的活化能,所以该反应生成物的活化能为E1+41.2kJ。
(2)由反应CH3OH(g) +H2O(g)![]() CO2(g)+3H2(g) ΔH=+49.5kJ/mol 可知,正反应是气体分子数增大的吸热反应,所以温度越高,体系中甲醇的平衡转化率越高,压强越小,体系中甲醇的平衡转化率越高。
CO2(g)+3H2(g) ΔH=+49.5kJ/mol 可知,正反应是气体分子数增大的吸热反应,所以温度越高,体系中甲醇的平衡转化率越高,压强越小,体系中甲醇的平衡转化率越高。
①该反应的平衡常数表达式为K=![]() 。
。
②当温度为250℃、压强为P2时,甲醇的平衡转化率为82%,由CH3OH(g) +H2O(g)![]() CO2(g)+3H2(g),设起始时n(CH3OH)=n(H2O) =1mol,则平衡时,n(CH3OH)=n(H2O) =0.18mol,n(CO2)=0.82mol,n(H2)=2.46mol,反应达平衡时H2的体积分数为
CO2(g)+3H2(g),设起始时n(CH3OH)=n(H2O) =1mol,则平衡时,n(CH3OH)=n(H2O) =0.18mol,n(CO2)=0.82mol,n(H2)=2.46mol,反应达平衡时H2的体积分数为![]() 67.6%(或0.676或0.68)。
67.6%(或0.676或0.68)。
③图中的压强由小到大的顺序是P1<P2<P3 。
④根据主副反应分析,氢气的产率随压强的增大而减少,其原因是随着压强增大,反应①逆向移动,反应②不移动,副反应③正向移动,导致氢气的产率下降 。
(3)MFC30氢氧燃料电池是以碳酸盐为电解质(提供CO32-)的高温型燃料电池,根据总反应为2H2+O2=2H2O,正极通入的气体必须是氧气和二氧化碳的混合气,电极反应为O2+4e-+2 CO2 =2 CO32-,所以负极的电极反应式为H2-2e-+CO32-=H2O+CO2 。


科目:高中化学 来源: 题型:
【题目】氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+ 2N2(g) ![]() Si3N4(s) + 6CO(g)
Si3N4(s) + 6CO(g)
(1)2molN2参加反应转移电子数为_________。
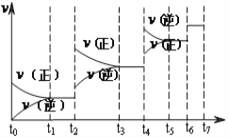
(2)达到平衡后,改变某一外界条件(不改变N2、CO的量),反应速率v与 时间t的关系如图。图中t4时引起平衡移动的条件可能是______________________;图中表示平衡混合物中CO的含量最高的一段时间是____________。
(3)若该反应的平衡常数为 K=729,则在同温度下1L密闭容器中,足量的SiO2和C与2mol N2充分反应,则N2的转化率是__________________ (提示:272 = 729)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法中正确的是
A. 12C、13C、14C是碳的三种同素异形体
B. H2S的电子式可表示为![]()
C. HCl、HBr、HI的稳定性逐渐减弱,而熔沸点逐渐升高
D. NaHSO4在熔融状态下不仅破坏了离子键,还破坏了共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL 0.1 mol/L的K2CO3溶液中逐滴加入0.1 mol/L的稀盐酸40 mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)的物质的量分数随溶液pH变化的情况如下图所示。下列说法正确的是
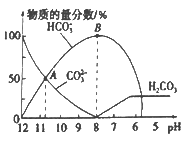
A. 随着稀盐酸的加入,溶液中![]() 保持不变
保持不变
B. 根据A点计算,Ka2 (H2CO3)的数量级为10-3
C. B 点所处的溶液中:c(K+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
D. 当pH约为8时,溶液中开始放出CO2气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲基丙烯酸甲酯是合成有机玻璃的单体,其合成方法之一如下:CH3OC≡CH+CH3OH+A ![]() CH2=C(CH3)COOCH3,下列说法正确的是
CH2=C(CH3)COOCH3,下列说法正确的是
A. 已知该反应的原子利用率为100%,则A为CO2
B. CH3OH和甘油互为同系物
C. CH3C≡CH与丙烯的性质相似,则该物质可以发生加成、氧化反应
D. 能与NaHCO3反应的CH2=C(CH3)COOCH3的同分异构体有9种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠NaNO2是一种工业盐,人若误食会引起中毒。某课外活动小组拟采用高锰酸钾滴定法测定某样品中NaNO2的质量分数:称取1.0g该样品于锥形瓶中,加入适量水溶解,然后用0.1000mol/L的KMnO4溶液(适量稀H2SO4酸化)进行测定,并重复上述操作2-3次。回答下列问题:
(1)滴定过程中反应的离子方程式为_____________。
(2)滴定终点的判断方法是______________。
(3)若滴定终点时平均消耗20.00mL标准溶液,该样品中NaNO2的质量分数为___________。
(4)下列操作中可能使测定结果偏高的是______________。
A.滴定结束后,滴定管尖嘴处有一悬挂液滴
B.滴定管尖嘴部分滴定前有气泡,滴定终了无气泡
C.滴定前仰视滴定管刻度线,滴定终点平视刻度线
D.锥形瓶用蒸馏水洗涤后,直接加入待测液进行滴定
(5)该小组还想设计实验证明:酸性条件下NaNO2具有氧化性,实验操作为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】使用胆矾(CuSO4·5H2O)配制1L 0.2 mol·L-1的硫酸铜溶液,正确的操作是( )
A. 将胆矾加热除去结晶水后,称取32 g溶解在1 L水里
B. 称取胆矾50 g,溶解在1 L水里
C. 将32 g胆矾溶于水,然后将此溶液稀释至1 L
D. 将50 g胆矾溶于水,然后将此溶液稀释至1 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分类组合全部正确的是
编组 | 强电解质 | 弱电解质 | 非电解质 |
A | NaCl | HF | Cl2 |
B | H2SO4 | BaCO3 | CO2 |
C | AgCl | HClO | Cu |
D | Ca(OH)2 | H2S | 蔗糖 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com