
【题目】全氮类物质具有高密度、超高能量及爆炸产物无污染等优点,被称为没有核污染的“N2爆弹”。中国科学家胡炳成教授团队近日成功合成全氮阴离子N5-,N5-是制备全氮类物质N10(其中含有![]() 和N5-两种离子)的重要中间体。下列说法中不正确的是( )
和N5-两种离子)的重要中间体。下列说法中不正确的是( )
A.全氮类物质属于绿色能源B.每个N5+中含有5个原子核
C.每N5-中含有36个质子D.N10结构中含非极性共价键和离子键
科目:高中化学 来源: 题型:
【题目】据《X-MOL》报道:RobertPipes等设计的添加PDS(![]() )的Li-CO2电池,正极物质转化原理如图所示。下列说法错误的是( )
)的Li-CO2电池,正极物质转化原理如图所示。下列说法错误的是( )

A.PDS起增强导电性作用
B.负极反应式为Li-e-=Li+
C.电池总反应为4Li+3CO2=2Li2CO3+C
D.正极上发生的反应之一为![]() +2CO2+2e-=2
+2CO2+2e-=2![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙三个容器中最初存在的物质及其数量如图所示,三个容器最初的容积相等、温度相同,反应中甲、丙的容积不变,乙中的压强不变,在一定温度下反应达到平衡。下列说法正确的是

A.平衡时各容器内c(NO2)的大小顺序为乙>甲>丙
B.平衡时N2O4的百分含量:乙>甲=丙
C.平衡时甲中NO2与丙中N2O4的转化率不可能相同
D.平衡时混合物的平均相对分子质量:甲>乙>丙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2的排放会带来全球“温室”效应,因此,引起国际关注和研究,渴望21世纪 CO2将作为新碳源被广泛使用。
(1)以 CO2 和 H2 为原料可得到 CH4 燃料。
已知:① CH4 (g) + CO2(g) = 2CO(g) + 2H2(g) △ H1= + 247kJ·mol-1
② CH4 (g) + H2O(g) = CO(g) + 3H2(g) △ H2= + 205kJ·mol-1
写出由 CO2 获得CH4的热化学方程式:_____。
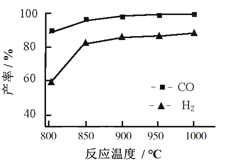
(2)CO2与CH4经催化重整可制得合成气:CH4(g)+CO2(g) = CO(g)+2H2(g) 按一定体积比加入CH4和CO2,在恒压下发生反应,温度对CO和H2产率影响如图所示。此反应优选温度为900℃的原因是______________________。
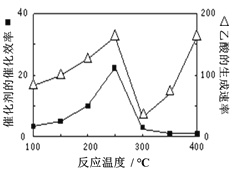
(3)以二氧化钛表面覆盖的Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
① 催化剂的催化效率与乙酸的生成速率随温度的变化关系如上图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是__________________。
② 为了提高该反应中CH4的转化率,可以采取的措施是________(写出两种) 。
③ 将Cu2Al2O4溶解在稀硝酸中离子方程式是________________________。
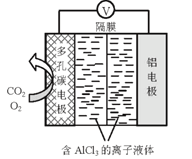
(4)O2辅助的Al—CO2电池工作原理如上图所示。该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。电池的负极反应式:_______________________。电池的正极反应式:2CO2+2e= C2O42该过程中,O2起催化作用,催化过程可表示为:i: 6 O2 + 6e = 6 O2 ii: ……写出ii的离子方程式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W四种物质间的转化关系如图所示 ,下列转化不能一步实现的是
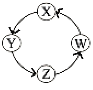
序号 | X | Y | Z | W |
A | N2 | NH3 | NO | NO2 |
B | Na | NaOH | Na2CO3 | NaCl |
C | Cl2 | Ca(ClO)2 | HClO | HCl |
D | H2S | S | SO3 | H2SO4 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤、石油、淀粉都是基础的化工原料,它们之间存在如下关系(部分产物和反应条件未标出)。B为相对分子质量为28的烃;E为淀粉水解的最终产物;F分子中含有一个甲基和一个羧基,lmolF与足量的钠反应能生成标况下22.4LH2;D物质中也含有羧基。

回答下列各题:
(1)若A为煤焦油,则从A中分离出苯的方法是__________,工业上通过石油的________制B物质.
(2)C为乙苯,则苯和B生成C的反应类型是____________, C的结构简式是____________.
(3)写出B制备聚乙烯的反应方程式_____________________________________________.
(4)写出D与F转化为G的反应方程式________________________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向50mL含有0.1molCl2的氯水中滴加2mol·L1的NaOH溶液,得到溶液pH随加入NaOH溶液体积的变化如图所示。下列说法正确的是
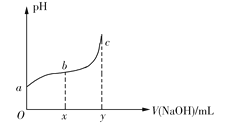
A.若a点pH=4,且c(Cl)=mc(HClO),则HClO的电离平衡常数为![]()
B.若x=100,b点对应溶液中,c(OH)>c(H+),可用pH试纸测定其pH
C.若y=200,c点对应溶液中,c(OH)c(H+)=2c(Cl)+c(HClO)
D.b→c段,随NaOH溶液的滴入,![]() 逐渐增大
逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在298K、100kPa时,1L水中可溶解0.09molCl2,实验测得溶于水的Cl2约有三分之一与水反应。下列说法正确的是
A.氯气与水反应的离子反应方程式为:Cl2 + H2O ![]() 2H+ + Cl—+ ClO—
2H+ + Cl—+ ClO—
B.为了增大氯水中HClO的浓度,可以向氯水中加入足量的NaOH固体,使氯气与水反应的平衡向右移动
C.向该条件下的氯水中加入盐酸,氯气与水反应的平衡移动方向与盐酸的浓度有关
D.向氯水中通入HCl气体,氯气与水反应的平衡向左移动,氯水的酸性减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:邻苯二甲酸(H2A)的Ka1=1.1×10-3,Ka2=3.9×10-6。室温下,用0.1 mol·L-1 NaOH溶液滴定20 mL 0.1 mol·L-1邻苯二甲酸氢钾(KHA)溶液。下列说法正确的是( )
A.0.1 mol·L-1 KHA溶液中:c(K+)>c(HA-)+2c(A2-)
B.加入NaOH溶液至pH=8时:c(K+)>c(A2-)>c(HA-)>c(H2A)
C.加入20 mL NaOH溶液时:c(OH-)+c(A2-)=c(Na+)+c(H+)+c(H2A)
D.在滴定过程中,水的电离程度一直减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com