
| ||
| 加热 |
| ||
| 加热 |
| 氧化 |


科目:高中化学 来源: 题型:
| A、2HCl+CaCO3═CaCl2+CO2↑+H2O |
| B、HCl+K2CO3═KCl+KHCO3+H2O |
| C、HCl+NaHCO3═NaCl+CO2↑+H2O |
| D、2HNO3+(NH4)2CO3═2NH4NO3+CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、胶体是一种带电的分散系 |
| B、可以用丁达尔现象区别胶体与溶液 |
| C、胶体和浊液不能透过滤纸而溶液可以 |
| D、向氢氧化铁胶体中加入硫酸钠不能出现沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
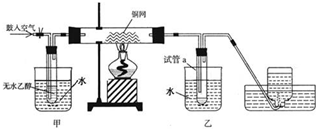
 实验室制取乙烯的装置如图所示,请回答:
实验室制取乙烯的装置如图所示,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:

A、母液中含有大量的Na+、NH
| ||||
B、通入NH3只是为了增加NH
| ||||
| C、加入的Y物质为CO2 | ||||
| D、生产过程中还需要补充水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铜锌原电池工作时,电子从负极出发沿外电路回到正极 |
| B、原电池的负极发生还原反应 |
| C、甲醇燃料电池可把化学能转化为电能 |
| D、锌锰干电池中,锌电极是负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com