
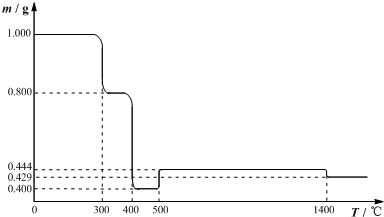
| 实验操作 | 实验目的 | |
| A | 将潮湿的NH3通过盛有无水CaCl2的干燥管 | 除去NH3中的水蒸气 |
| B | 往铁和稀硝酸反应后的溶液中滴入KSCN溶液 | 验证溶液中是否含有Fe3+ |
| C | 甲基橙作指示剂,用标准NaOH溶液滴定盐酸至红色 | 测量盐酸物质的量浓度 |
| D | 向2ml0.2mol/L的AgNO3溶液中先后滴加0.2mol/L 的NaCl溶液、KBr溶液各5滴 | 确定AgCl、AgBr的Kap的相对大小 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.氨气和氯化钙能发生络合反应;
B.溶液显血红色,一定生成铁离子;
C.达到滴定终点时,溶液颜色由橙变黄;
D.AgNO3过量,不能比较溶解度大小.
解答 解:A.氨气和氯化钙能发生络合反应,所以氯化钙不能干燥氨气,故A错误;
B.溶液显血红色,一定生成铁离子,不能确定是否存在亚铁离子,即Fe与硝酸反应后溶液中肯定有Fe3+,可能还有Fe2+,故B正确;
C.甲基橙的变色范围是3.1-4.4,用碱滴定酸时,甲基橙加在酸里,达到滴定终点时,溶液颜色由橙变黄,故C错误;
D.AgNO3过量,不能比较溶解度大小,可在饱和氯化银溶液中滴加溴化钠溶液比较,故D错误.
故选B.
点评 本题考查化学实验方案的评价,为高频考点,侧重于考查学生的综合运用化学知识的能力和评价能力,注意把握相关物质的性质的异同,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,64 g SO2含有的原子数目为NA | |
| B. | 常温常压下,22.4 L O2含有的分子数目为NA | |
| C. | 1 mol镁与足量稀硫酸反应时失去的电子数目为2 NA | |
| D. | 1 mol•L-1K2SO4溶液中含有的钾离子数目为2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Z单质还原性大于Y单质 | |
| B. | X的氢化物沸点高于W的氢化物 | |
| C. | 仅含X、Y两元素的化合物均只含离子键 | |
| D. | 上述四种元素形成的简单离子中,X离子半径最小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 青铜的熔点比纯铜和锡都高 | B. | 陶瓷的主要成分为硅酸盐 | ||
| C. | 古代的纸张主要成分为蛋白质 | D. | 黑火药爆炸时,氧化剂只有硝酸钾 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温常压下,2.24LSO2与O2混合气体中所含氧原子数为0.2NA | |
| B. | 50mL12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA | |
| C. | 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA | |
| D. | 标准状况下,20gD20分子中所含中子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KNO3 | B. | K2CO3 | C. | HNO3 | D. | Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示(夹持仪器已略去).
某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示(夹持仪器已略去).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
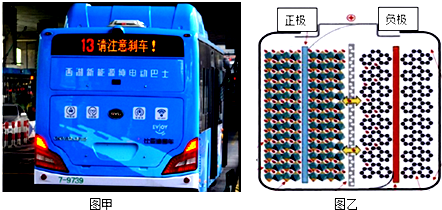
| A. | 充电时阳极反应可表示为LiFePO4-xe-=Li1-xFePO4+xLi+ | |
| B. | 充电时阴极反应可表示为xLi++xe-+6C=LixC6 | |
| C. | 放电时负极反应可表示为LixC6-xe-=xLi++6C | |
| D. | 放电时Li+从左向右通过离子交换膜 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com