
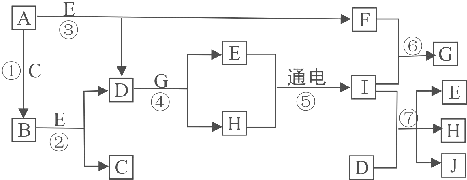
分析 常温下A为金属单质,B为淡黄色粉末,C是气体单质,A和C反应生成B,则A是Na,B是Na2O2,C是O2;E在常温下为液体,能与过氧化钠反应生成氧气与D,则E是H2O,D为NaOH,而A与E反应生成D与气体单质F,则F是H2,氢气与氧气可以合成水,H的水溶液通电生成氢气、气体单质I和氢氧化钠,应为电解饱和食盐水的反应,则I为Cl2,可知G为HCl,H为NaCl,Cl2和NaOH反应生成NaCl、H2O和NaClO,则J为NaClO,次氯酸钠可用作杀菌消毒剂,据此解答.
解答 解:常温下A为金属单质,B为淡黄色粉末,C是气体单质,A和C反应生成B,则A是Na,B是Na2O2,C是O2;E在常温下为液体,能与过氧化钠反应生成氧气与D,则E是H2O,D为NaOH,而A与E反应生成D与气体单质F,则F是H2,氢气与氧气可以合成水,H的水溶液通电生成氢气、气体单质I和氢氧化钠,应为电解饱和食盐水的反应,则I为Cl2,可知G为HCl,H为NaCl,Cl2和NaOH反应生成NaCl、H2O和NaClO,则J为NaClO,次氯酸钠可用作杀菌消毒剂.
(1)B是Na2O2,与E(H2O) 组成元素相同的化合物的化学式为H2O2,
故答案为:Na2O2;H2O2;
(2)反应①是钠与氧气反应生成过氧化钠,属于化合反应、氧化还原反应,
故选:ac;
(3)⑦为Cl2和NaOH溶液的反应,反应的方程式为:Cl2+2NaOH=NaCl+NaClO+H2O,
故答案为:Cl2+2NaOH=NaCl+NaClO+H2O;
(4)A为Na,具有钠离子方法为焰色反应,
故答案为:焰色反应.
点评 本题考查无机物的推断,综合性较强,突破口为“B为淡黄色粉末,E在常温下为液体”,再结合转化关系推断,掌握元素化合物性质是关键,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CO和H2作为重要的燃料和化工原料,有着十分广泛的应用.
CO和H2作为重要的燃料和化工原料,有着十分广泛的应用.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(CO)=1.6 mol/(L•min) | B. | v(N02)=0.9 mol/(L•min) | ||
| C. | V(N2)=0.25 mol/(L•min) | D. | v(CO2)=1.2 mol/(L•min) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com