
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Mg2+ | 8.3 | 9.8 |
| Cu2+ | 4.4 | 6.4 |
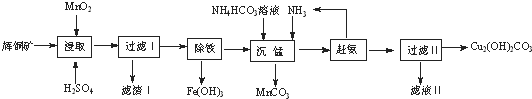
分析 (1)矿石颗粒大小、温度、反应物浓度等因素影响反应速率;
(2)反应物是二氧化锰、硫化铜和硫酸,生成物是S、硫酸铜、硫酸锰,根据化合价升降相等配平,浸取后SiO2、反应生成的S都在滤渣Ⅰ中;
(3)过滤Ⅰ的溶液呈酸性,调节PH目的是除去Fe3+离子,可以用氨水,不会引入新杂质,根据阳离子生成氢氧化物沉淀的pH范围,选择PH范围;
(4)“沉锰”(除Mn2+)过程,主要是使Mn2+生成沉淀MnCO3,温度升高氨气在水中的溶解度减小;
(5)根据0.2000mol•L的Zn2+标准溶液滴定至终点,消耗标准溶液18.00mL,根据EDTA~Zn2+可求得与Zn2+反应的EDTA的物质的量为0.003600mol,而EDTA的总物质的量为40.00mL×0.2000mol•L-1=0.008000mol,所以与Cu2+反应的EDTA的物质的量为0.004400mol,根据EDTA~Cu2+可求得Cu2+的物质的量为0.004400mol,实验时将样品配成250mL,再取25.00mL,所以6.2500g样品中含有碳酸铜的物质的量为$\frac{250}{25}$×0.004400mol=0.04400mol,根据纯度=$\frac{纯碱式碳酸铜的质量}{样品的质量}$×100%可计算出样品中Cu2(OH)2CO2的质量分数.
解答 解:(1)酸浸时,通过粉碎矿石或者升高温度或者进行搅拌或都增加酸的浓度,都可以提高浸取速率,
故答案为:粉碎矿石、升高温度(或适当增加酸的浓度或搅拌);
(2)反应物是二氧化锰、硫化铜和硫酸,生成物是S、硫酸铜、硫酸锰,反应的方程式为2MnO2+Cu2S+4H2SO4=S↓+2CuSO4+2MnSO4+4H2O,浸取后SiO2、反应生成的S,都不溶解,都在滤渣Ⅰ中,
故答案为:2MnO2+Cu2S+4H2SO4=S↓+2CuSO4+2MnSO4+4H2O;SiO2、S;
(3)过滤Ⅰ的溶液呈酸性,调节PH目的是除去Fe3+离子,可以用氨水,不会引入新杂质,要除去滤液中的Fe3+离子,PH=3.2,Fe3+离子完全沉淀,PH=4.4,铜离子开始沉淀,故pH范围是3.2≤pH<4.4,
故答案为:氨水;3.2≤PH<4.4;
(4)“沉锰”(除Mn2+)过程,主要是使Mn2+生成沉淀MnCO3,反应的离子方程式为Mn2++CO32-=MnCO3↓,温度升高氨气在水中的溶解度减小,所以赶氨时,最适宜的操作方法为给溶液加热,
故答案为:Mn2++CO32-=MnCO3↓;加热;
(5)根据0.2000mol•L的Zn2+标准溶液滴定至终点,消耗标准溶液18.00mL,根据EDTA~Zn2+可求得与Zn2+反应的EDTA的物质的量为0.003600mol,而EDTA的总物质的量为40.00mL×0.2000mol•L-1=0.008000mol,所以与Cu2+反应的EDTA的物质的量为0.004400mol,根据EDTA~Cu2+可求得Cu2+的物质的量为0.004400mol,实验时将样品配成250mL,再取25.00mL,所以6.2500g样品中含有碳酸铜的物质的量为$\frac{250}{25}$×0.004400×$\frac{1}{2}$mol=0.02200mol,根据纯度=$\frac{纯碱式碳酸铜的质量}{样品的质量}$×100%可得样品中Cu2(OH)2CO2的质量分数=$\frac{0.02200×(64×2+17×2+60)}{6.2500}$×100%=78.14%,
故答案为:78.14%.
点评 本题考查了硫酸锰和碱式碳酸铜的制取,涉及的知识点比较多,可以根据信息及所学知识,合理分析得出正确结论,本题难度中等.


 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:选择题
| A. | Z>X>Y | B. | X>Y>Z | C. | Z>Y>X | D. | X>Z>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11种 | B. | 12种 | C. | 13种 | D. | 14种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
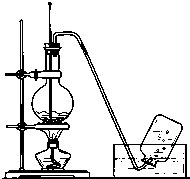 实验室常用如图所示装置制取乙烯,制取时:
实验室常用如图所示装置制取乙烯,制取时:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
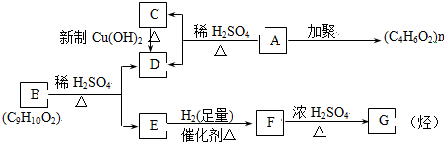
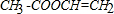 ,B:
,B: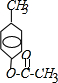 ;
;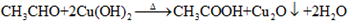 ,
,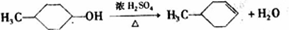 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2O和CO2分子中的中心原子均采用sp2杂化 | |
| B. | 甲胺(分子式CH3NH2)的沸点比三甲胺(分子式(CH3)3N)的沸点高 | |
| C. | C6H6分子中含有6个σ键和1个大π键,C6H6是非极性分子 | |
| D. | CH3SH 的相对分子质量比CH3OH大,因此前者的沸点高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com