分析:(1)①先根据溶液的pH计算氢氧根离子浓度,再根据c
1V
1=c
2(V
1+V
2)计算加入的水体积;
②先根据溶液的pH计算氢氧根离子浓度,再根据c
1V
1+c
2V
2=c
3(V
1+V
2)计算加入的氢氧化钠溶液体积;
③先计算混合溶液中氢氧根离子浓度,再根据c(OH
-)=
.
(2)酸或碱抑制水电离,含有弱根离子的盐促进水电离;能形成原电池的装置能加快反应速率;
(3)根据氢离子浓度及水的离子积常数计算氢氧根离子浓度;
(4)从盐类的水解角度分析;
(5)明矾是KAl(SO
4)
2?12H
2O,其溶液中离子浓度由大到小的顺序是不水解的二元硫酸根离子浓度最大,钾离子和铝离子要考虑铝的水解,结合水解呈酸性;因铝离子水解生成氢氧化铝胶体起净水作用;明矾晶体溶于水后的溶液中加入Ba(OH)
2溶液,当溶液中的SO
42-刚好完全沉淀时,二者以1:2反应,反应生成硫酸钡、偏铝酸钾、水,以此来解答;
(6)FeCl
3是强酸弱碱盐,铁离子水解而导致其溶液呈酸性;为防止氯化铁水解,在配制氯化铁溶液时,常将FeCl
3固体先溶于较浓的盐酸中;
(7)醋酸是弱电解质部分电离;加热蒸干并灼烧最终得到的是金属氧化物.
解答:
解:(1)①pH=12 的NaOH溶液中氢氧根离子浓度是0.01mol/L,pH=11的氢氧化钠溶液中氢氧根离子浓度是0.001mol/L,设加入水的体积是V
2,c
1V
1=c
2(V
1+V
2)=0.01mol/L×0.1L=(0.1+V
2)L,V
2=
=0.9L=900mL,
故答案为:900;
②pH=12 的NaOH溶液中氢氧根离子浓度是0.01mol/L,pH=11的氢氧化钠溶液中氢氧根离子浓度是0.001mol/L,pH=10的氢氧化钠溶液中氢氧根离子浓度是0.0001mol/L,设加入pH=10的NaOH溶液体积是V
2,
c
1V
1+c
2V
2=c
3(V
1+V
2)=0.01mol/L×0.1L+0.0001mol/L×V
2=0.001mol/L(0.1+V
2),
V
2=1L=1000mL,
故答案为:1000;
③pH=2的HCl溶液中氢离子浓度是0.01mol/L,设加入盐酸的体积是V,
c(OH
-)=
=
| 0.01mol/L×(0.1-V)L |
| (0.1+V)L |
=0.001mol/L,
V=81.8mL,故答案为:81.8;
(2)水电离生成氢离子和氢氧根离子,所以酸能抑制水电离,锌和硫酸反应生成硫酸锌和氢气,硫酸锌是强酸弱碱盐,促进水电离,所以水的电离平衡向右移动;
a.向溶液中加入NaNO
3,导致溶液中含有硝酸,硝酸和锌反应不产生氢气,故a错误;
b.CuSO
4和锌发生置换反应生成铜,铜、锌和稀硫酸构成原电池,所以能加快反应速率,故b正确;
c.Na
2SO
4 不影响反应速率,故c错误;
d.NaHCO
3和硫酸反应生成二氧化碳,氢离子浓度减小,所以生成氢气的速率减小,故d错误;
e.加入CH
3COONa,醋酸是弱电解质,导致溶液中氢离子浓度减小,生成氢气速率减小,故e错误;
故答案为:向右;b;
(3)该溶液中氢离子浓度为10
-10,mol/L,则溶液中氢氧根离子浓度=
mol/L=10
-4mol/L,所以由水电离出的OH
-离子浓度与溶液中的H
+离子浓度之比为10
6:1,故答案为:10
6:1;
(4)HCO
3-水解,反应为:HCO
3-+H
2O?H
2CO
3+OH
-,溶液呈碱性;Al
3+水解,反应为:Al
3++3H
2O?Al(OH)
3+3H
+,Al
2(SO
4)
3溶液呈酸性;NaHCO
3溶液跟Al
2(SO
4)
3溶液混合,发生相互促进的水解:3HCO
3-+Al
3+=3CO
2↑+Al(OH)
3↓,产生大量的气体和沉淀,故答案为:3HCO
3-+Al
3+=3CO
2↑+Al(OH)
3↓;
(5)明矾是KAl(SO
4)
2?12H
2O,其溶液中离子浓度由大到小的顺序是不水解的二元硫酸根离子浓度最大,钾离子和铝离子要考虑铝的水解,结合水解呈酸性,所以离子浓度大小顺序为:c(SO
42-)>c(K
+)>c(Al
3+)>c(H
+)>c(OH
-);因铝离子水解生成氢氧化铝胶体起净水作用,水解离子反应为Al
3++3H
2O?Al(OH)
3(胶体)+3H
+;
明矾晶体溶于水后的溶液中加入Ba(OH)
2溶液,当溶液中的SO
42-刚好完全沉淀时,二者以1:2反应,反应生成硫酸钡、偏铝酸钾、水,该离子反应为Al
3++2SO
42-+2Ba
2++4OH
-═AlO
2-+2BaSO
4↓+2H
2O,
故答案为:c(SO
42-)>c(K
+)>c(Al
3+)>c(H
+)>c(OH
-);Al
3++3H
2O?Al(OH)
3(胶体)+3H
+;碱;Al
3++2SO
42-+2Ba
2++4OH
-═AlO
2-+2BaSO
4↓+2H
2O;
(6)FeCl
3是强酸弱碱盐,铁离子水解而导致其溶液呈酸性,水解离子方程式为Fe
3++3H
2O?Fe(OH)
3+3H
+,所以其溶液pH<7;在配制氯化铁溶液时,常将FeCl
3固体先溶于较浓的盐酸中,从而抑制氯化铁水解,故答案为:酸;<;Fe
3++3H
2O?Fe(OH)
3+3H
+;抑制;
(7)醋酸是弱电解质部分电离,电离方程式为:CH
3COOH?CH
3COO
-+H
+;AlCl
3属于强酸弱碱盐水解显酸性,其水解离子方程式表示为:Al
3++3H
2O?Al(OH)
3+3H
+,氯化铝水溶液在加热时水解生成Al(OH)
3和HCl,HCl易挥发,灼烧得到Al
2O
3,
故答案为:CH
3COOH?CH
3COO
-+H
+;Al
2O
3.



 和
和 :
: ,
, 和C6H12(已烯):
和C6H12(已烯): ,CCl4和乙醇
,CCl4和乙醇 的系统命名:
的系统命名: 的键线式:
的键线式: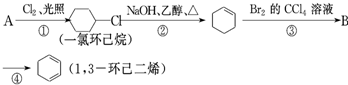
 全钒氧化还原液流电池是一种新型电能储存和高效转化装置,该电池是将具有不同价态的钒离子溶液分别作为正极和负极的活性物质,分别储存在各自的酸性电解液储罐中.其结构原理如图所示,该电池放电时,右槽中的电极反应为:V2+-e-═V3+,下列说法正确的是( )
全钒氧化还原液流电池是一种新型电能储存和高效转化装置,该电池是将具有不同价态的钒离子溶液分别作为正极和负极的活性物质,分别储存在各自的酸性电解液储罐中.其结构原理如图所示,该电池放电时,右槽中的电极反应为:V2+-e-═V3+,下列说法正确的是( )