
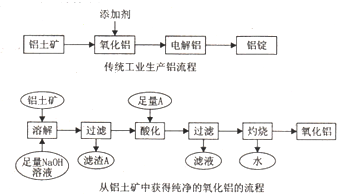
分析 铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质,加入足量的氢氧化钠,氧化铝、二氧化硅与NaOH溶液反应均生成盐和水,只有氧化铁与碱不反应,结合信息②可知还生成Na2Al2Si2O8沉淀,过滤后得滤渣Fe2O3、Na2Al2Si2O8;滤液用二氧化碳酸化时,将NaAlO2完全转化为Al(OH)3,反应的离子方程式为:AlO2-+2H2O+CO2═HCO3-+Al(OH)3↓;过滤得氢氧化铝沉淀,灼烧得氧化铝,电解氧化铝得单质铝.
(1)冶炼铝的电解槽中的阴极和阳极材料均为惰性电极;
(2)氧化铝的熔点很高,在铝的冶炼中要加入冰晶石可以降低氧化铝的熔化温度;
(3)依据电极反应和电子守恒计算,阳极消耗是因为电解过程中生成的氧气和电极材料碳发生反应当生成一氧化碳时消耗碳最多;
(4)只有氧化铁与碱不反应,结合信息②可知还生成Na2Al2Si2O8,依据滤渣的组成分析判断A的用途;
(5)第三步中,选用二氧化碳作酸化剂,可将Al元素全部转化为沉淀,氢氧化铝不溶于弱酸;
(6)氧化镁熔点高,氯化镁熔点低,氯化铝为共价化合物,熔化后不导电,而氧化铝为离子化合物.
解答 解:铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质,加入足量的氢氧化钠,氧化铝、二氧化硅与NaOH溶液反应均生成盐和水,只有氧化铁与碱不反应,结合信息②可知还生成Na2Al2Si2O8沉淀,过滤后得滤渣Fe2O3、Na2Al2Si2O8;滤液用二氧化碳酸化时,将NaAlO2完全转化为Al(OH)3,反应的离子方程式为:AlO2-+2H2O+CO2═HCO3-+Al(OH)3↓;过滤得氢氧化铝沉淀,灼烧得氧化铝,电解氧化铝得单质铝.
(1)冶炼铝的电解槽中的阴极和阳极材料均为惰性电极,在工业电解铝的过程中,用石油炼制和煤的干馏产品中的石墨作电解铝的阴极和阳极材料,
故答案为:石墨;
(2)氧化铝的熔点很高,工业上为了降低能量消耗,在铝的冶炼中要加入冰晶石可以降低氧化铝的熔化温度,
故答案为:冰晶石;
(3)阳极消耗是因为电解过程中生成的氧气和电极材料碳发生反应生成二氧化碳,阳极电极反应为:2O2--4e-=O2↑,阴极电极反应为Al3++3e-=Al,结合电子守恒得到3O2~4Al,电极消耗反应生成一氧化碳时压强消耗的碳最多,2C+O2=2CO,
当生成2.16t铝时消耗阳极
6C~3O2~4Al
6×12 4×27
m 2.16t
m=1.44t,
故答案为:1.44;
(4)只有氧化铁与碱不反应,结合信息②可知还生成Na2Al2Si2O8,图中滤液A的主要成分为Fe2O3、Na2Al2Si2O8 ,依据滤渣的组成分析判断A的用途可以做炼铁的原料或生产硅酸盐产品,
故答案为:Fe2O3、Na2Al2Si2O8 ,炼铁的原料或生产硅酸盐产品;
(5)第三步“酸化”中,选用二氧化碳作酸化剂,过量的二氧化碳通入偏铝酸钠溶液中可将Al元素全部转化为氢氧化铝沉淀,因为氢氧化铝不溶于弱酸碳酸,且二氧化碳来源广,反应易控制廉价,
故答案为:CO2,二氧化碳过量时氢氧化铝不会溶解,反应易控制且廉价;
(6)氧化镁熔点高,氯化镁熔点低,熔融后电离出离子能导电,工业冶炼镁是电解熔融的氯化镁,氯化铝为共价化合物,熔化后不导电,而氧化铝为离子化合物熔融可以电离出离子能导电,工业冶炼铝是电解熔融的氧化铝冰晶石熔融体,
故答案为:因为氧化镁熔点太高,氯化镁熔点低,熔化时能发生电离导电,氯化铝是共价化合物熔化时不发生电离不能导电.
点评 本题考查Al及其化合物的化学性质、物质分离提纯方法和基本操作的综合应用,注意把握流程中发生的化学反应为解答的关键,注重信息与所学知识的结合分析解决问题,侧重知识迁移应用能力的考查,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ① | ⑩ | ||||||
| 2 | ⑥ | ⑦ | ||||||
| 3 | ② | ③ | ④ | ⑧ | ||||
| 4 | ⑤ | ⑨ |
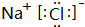 ,高温下灼烧该化合物火焰呈黄色.
,高温下灼烧该化合物火焰呈黄色.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 叙述I | 叙述II |
| A | 晶体硅熔点高硬度大 | 可用于制作半导体材料 |
| B | BaSO4难溶于酸 | 用硫酸和BaCl2溶液检验SO42- |
| C | NH3极易溶于水 | NH3可用于设计喷泉实验 |
| D | NaOH可以与SiO2反应 | 用NaOH溶液雕刻工艺玻璃上的纹饰 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | H2C2O4(aq) | KMnO4(H+)(aq) | MnSO4(s) 质量(g) | 褪色时间(g) | ||
| C(mo•L-1) | V(mL) | C(mol•L-1) | V(mL) | |||
| 实验1 | 0.1 | 2 | 0.01 | 4 | 0 | 30 |
| 实验2 | 0.1 | 2 | 0.01 | 4 | 5 | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮及其化合物在化学实验中有广泛应用:
氮及其化合物在化学实验中有广泛应用:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 排布在K、L、M三个电子层上 | B. | 3p能级上有2个空轨道 | ||
| C. | 共有16种不同的运动状态 | D. | 共有5种不同的能级 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/min | 0 | 20 | 40 | 60 | 80 |
| c(H2O2)/mol•L-1 | 0.80 | 0.40 | 0.20 | 0.10 | 0.05 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com