
| A. | KMnO4 | B. | NH3•H2O | C. | HNO3 | D. | H2O2 |
分析 A.加热高锰酸钾时,高锰酸钾分解生成锰酸钾、二氧化锰和氧气;
B.加热一水合氨时,一水合氨分解生成氨气和水;
C.加热硝酸分解生成二氧化氮、氧气和水;
D.加热双氧水,双氧水分解生成水和氧气.
解答 解:A.加热高锰酸钾时,高锰酸钾分解生成锰酸钾、二氧化锰和氧气,反应方程式为:2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑,有单质氧气生成,故A错误;
B.加热一水合氨时,一水合氨分解生成氨气和水,反应方程式为NH3.H2O$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O,没有单质生成,故B正确;
C.加热硝酸分解生成二氧化氮、氧气和水,反应方程式为:4HNO3$\frac{\underline{\;\;△\;\;}}{\;}$4NO2↑+O2↑+2H2O,有单质生成,故C错误;
D.加热双氧水,双氧水分解生成水和氧气,反应方程式为2H2O2$\frac{\underline{\;\;△\;\;}}{\;}$2H2O+O2↑,有单质生成,故D错误.
故选B.
点评 本题以物质的分解反应为载体考查了单质的判断,根据反应方程式结合单质的概念来分析解答即可,明确发生的化学反应是解本题关键,题目难度不大.


 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:填空题
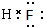 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1 Na2CO3溶液中:c(Na+)=c(HCO3-)+c(H2CO3)+2c(CO32-) | |
| B. | pH=12的Ba(OH)2溶液和pH=12的NaHCO3溶液中,水电离的c(H+)相等 | |
| C. | 将0.2 mol•L-1 NaA溶液和0.1 mol•L-1盐酸溶液等体积混合所得碱性溶液中:c(Na+)+c(H+)=c(A-)+c(Cl-) | |
| D. | 常温下,pH=4的醋酸与pH=10的NaOH溶液等体积混合后c(OH-)<c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 常压下五种元素的单质中,Z单质的沸点最高 | |
| B. | Y、Z的阴离子电子层结构都与R原子的相同 | |
| C. | 最高价氧化物对应的水化物的酸性W强于X | |
| D. | Y元素非金属性比W元素的非金属性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 氯酸钾和亚硫酸氢钾溶液能发生氧化还原反应:
氯酸钾和亚硫酸氢钾溶液能发生氧化还原反应:| A. | 反应开始时速率增大可能是c(H+)所致 | |
| B. | 纵坐标为v(Cl-)的v-t曲线与图中曲线完全重合 | |
| C. | 纵坐标为v(H+)的v-t曲线与图中曲线完全重合 | |
| D. | 后期反应速率下降的主要原因是反应物浓度减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;
;
 ),完成以邻甲基苯酚(
),完成以邻甲基苯酚( )和乙醇为原料制备合成
)和乙醇为原料制备合成 的路线流程图.
的路线流程图. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两容器中分子间的平均距离不相同 | |
| B. | 两容器中所含微粒的质量均相同 | |
| C. | 两容器中所含原子数、分子数、中子数均相同 | |
| D. | 两容器中所含质子数、中子数均相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
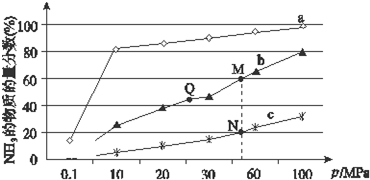
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com