
【题目】(1)下面是4种粒子的结构示意图:
A.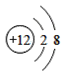 B.
B.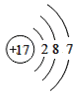 C.
C. D.
D.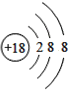
图中粒子共能表示______种元素,图中表示的阳离子是_______(用离子符号表示),图中C所表示的元素在元素周期表中的位置______。
(2)在1-18号的短周期主族元素中,表中的字母代表一种元素,回答下列问题:
C | D | ||||||||
A | B | E | F |
①D单质的电子式为:______;
②F的最高价氧化物对应水化物的化学式为:______;
③E和F分别形成的气态氢化物中稳定性较弱是______;(填写氢化物的化学式)
④A最高价氧化物的水化物所含化学键为_______,其水溶液与B的最高价氧化物的水化物反应的离子方程式为__。
【答案】3 Mg2+ 第三周期第ⅦA族 ![]() HClO4 H2S 离子键 共价键 Al(OH)3+OH-=[Al(OH)4]- 或Al(OH)3+OH-=AlO2-+2H2O
HClO4 H2S 离子键 共价键 Al(OH)3+OH-=[Al(OH)4]- 或Al(OH)3+OH-=AlO2-+2H2O
【解析】
(1)由四种粒子的结构示意图可知,核内的质子数有3种,则图中粒子表示3种元素;阳离子的核电荷数大于核外电子总数,四种粒子的结构示意图中,只有A的核内质子数(12)>核外电子数(10),表示的是阳离子,离子符号为Mg2+;C为Cl-,其原子序数=质子数=17,其原子结构示意图为 ,有三个电子层,最外层7个电子,则位于周期表中第三周期第 VIIA族;答案为:3,Mg2+,第三周期第 VIIA族。
,有三个电子层,最外层7个电子,则位于周期表中第三周期第 VIIA族;答案为:3,Mg2+,第三周期第 VIIA族。
(2)根据各元素的相对位置可知,A为Na元素、B为Al元素、C为C元素、D为N元素、E为S元素、F为Cl元素;
①D为N元素,其单质为N2,存在氮氮叁键,电子式为![]() ;答案为
;答案为![]() 。
。
②F为Cl元素,其最高正价为+7价,最高价氧化物对应水化物的化学式为HClO4;答案为HClO4。
③E为S元素、F为Cl元素,二者属于同周期元素,从左至右,非金属性增强,非金属性Cl>S,非金属性越强,对应氢化物的稳定性越强,则二者形成的气态氢化物中稳定性较弱的是H2S;答案为H2S。
④A为Na元素,其最高价氧化物的水化物为NaOH,其电子式为![]() ,则钠离子与氢氧根之间存在离子键,氢和氧之间存在共价键,B为Al元素,B的最高价氧化物的水化物为Al(OH)3,NaOH水溶液与Al(OH)3反应的离子方程式为Al(OH)3+OH-=[Al(OH)4]- 或Al(OH)3+OH-=AlO2-+2H2O;答案为离子键、共价键,Al(OH)3+OH-=[Al(OH)4]- 或Al(OH)3+OH-=AlO2-+2H2O。
,则钠离子与氢氧根之间存在离子键,氢和氧之间存在共价键,B为Al元素,B的最高价氧化物的水化物为Al(OH)3,NaOH水溶液与Al(OH)3反应的离子方程式为Al(OH)3+OH-=[Al(OH)4]- 或Al(OH)3+OH-=AlO2-+2H2O;答案为离子键、共价键,Al(OH)3+OH-=[Al(OH)4]- 或Al(OH)3+OH-=AlO2-+2H2O。


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数的值。下列说法正确的是
A.2.4 g Mg与足量硝酸反应生成NO和![]() 的混合气体,失去的电子数为
的混合气体,失去的电子数为![]()
B.1 mol甲苯分子中所含单键数目为![]()
C.![]() 的
的![]() 溶液中,由水电离出的H+数目一定是
溶液中,由水电离出的H+数目一定是![]()
D.![]() 、
、![]() 和
和![]() 的混合气体中所含分子数为
的混合气体中所含分子数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香草醛是一种食品添加剂,可由愈创木酚作原料合成,合成路线如下:

下列说法正确的是( )
A. 反应1→2属于加成反应,且生成的化合物2具有一个手性碳原子
B. 化合物2在一定条件下可发生消去反应
C. 检验制得的香草醛中是否混有化合物3,可用氯化铁溶液
D. 等物质的量四种化合物分别与足量NaOH反应,消耗NaOH物质的量之比为1:3:2:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA是阿伏加德罗常数的值,下列说法正确的是
A.12gNaHSO4晶体中SO42-数目为0.1NA
B.2.0gD2O中含有的中子数为NA
C.2.24LCl2与足量Na2SO3溶液反应时转移的电子数为0.2NA
D.标准状况下,4.48 LHF所含原子数目为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,回答下列问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
二 | ① | ② | ③ | ④ | ||||
三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)写出①、②两种元素的名称:______、______。
(2)写出⑧、⑨两种元素的符号______、______。
(3)在这些元素中,最活泼的金属元素的离子结构示意图是______最活泼的非金属元素是____(填元素符号,下同),______是最不活泼的元素。
(4)这些元素的最高价氧化物对应水化物中, _____(填化学式,下同)酸性最强, _____碱性最强;能形成两性氢氧化物的元素是______(填元素符号)。
(5)在⑤到![]() 的元素中, _____(填元素符号)原子半径最小。
的元素中, _____(填元素符号)原子半径最小。
(6)比较⑤和⑥的化学性质, _____(填元素符号)更活泼,试用实验证明之(简述操作、现象和结论)_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水杨酸是合成阿司匹林的重要原料。水杨酸的学名邻羟基苯甲酸,结构简式为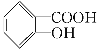 ,请回答下列问题:
,请回答下列问题:
(1)请写出水杨酸中具有的官能团名称________;
(2)能够区分水杨酸和苯酚的试剂_____ ___;
A.浓溴水 B.氢氧化钠溶液 C.氯化铁溶液 D.碳酸氢钠溶液
(3)水杨酸的另一种同分异构体的结构简式为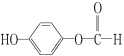 ,1 mol该有机物在适宜条件下与氢氧化钠经过一系列反应,最多能消耗氢氧化钠的物质的量为(填序号)________;
,1 mol该有机物在适宜条件下与氢氧化钠经过一系列反应,最多能消耗氢氧化钠的物质的量为(填序号)________;
A.1 mol B.2 mol C.3 mol D.4 mol
(4)已知有机物CH3COOH可以表示为:![]() ,在一定条件下,水杨酸与乙酸酐可合成阿司匹林,阿司匹林可表示为:
,在一定条件下,水杨酸与乙酸酐可合成阿司匹林,阿司匹林可表示为: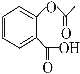 ,则阿司匹林分子式为________;
,则阿司匹林分子式为________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是( )
A.苯乙烯分子中所有原子可能共平面
B.苯、乙酸、乙醇均能发生取代反应
C.分子式为![]() 的同分异构体共有5种(不考虑立体异构)
的同分异构体共有5种(不考虑立体异构)
D.可用溴的四氯化碳溶液区分![]() 和
和![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数依次增大的X、Y、Z、W、M五种短周期主族元素中,X、Y两元素间能形成原子个数比分别为1:1和1:2的固态化合物A和B,Y是短周期元素中失电子能力最强的元素,W、M的最高价氧化 物对应的水化物化学式分别为H3WO4、HMO4,Z的单质能与盐酸反应。
(1)根据上述条件不能确定的元素是______(填代号),A的电子式为_____,举例说明Y、Z的金属性相对强弱:______(写出一个即可)。
(2)W能形成多种含氧酸及应的盐,其中NaH2WO2能与盐酸反应但不能与NaOH溶液反应,则下列说法中正确的是___________(填字母)
A H3WO2是三元酸
B H3WO2是一元弱酸
C NaH2WO2是酸式盐
D NaH2WO2不可能被硝酸氧化
(3)X、M形成的一种化合物MX2是一种优良的水处理剂,某自来水化验室利用下列方法裣测处理后的 水中MX2残留量是否符合饮用水标准(残留MX2的浓度不高于0.1 mgL-1),已知不同pH环境中含M粒子的种类如图所示:
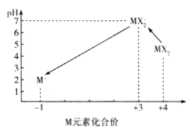
I.向100.00 mL水样中加入足量的KI,充分反应后将溶液调至中性,再加入2滴淀粉溶液。
向I中所得溶液中滴加2.0×10-4 molL-1的溶液至终点时消耗5.00 mL标准溶液 (已知 2S2O32- +I2 =S4O26- +2I-)。
①则该水样中残留的的浓度为______mgL-1。
②若再向II中所得溶液中加硫酸调节水样pH至13,溶液又会呈蓝色,其原因是____(用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五倍子是一种常见的中草药,其有效成分为X。在一定条件下X可分别转化为Y、Z。下列说法错误的是

A. 1molX最多能与2mol Br2发生取代反应 B. Y分子结构中有3个手性碳原子
C. Y能发生加成、取代、消去、氧化、缩聚反应 D. 1mol Z最多能与7mol NaOH反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com