
| A. | 二氧化硅溶于水显酸性 | |
| B. | 二氧化碳通入水玻璃(Na2SiO3的水溶液)可以得到白色胶状物质 | |
| C. | 因为高温时,二氧化硅与碳酸钠反应放出二氧化碳,所以硅酸的酸性比碳酸强 | |
| D. | 二氧化硅是酸性氧化物,它不溶于任何酸 |
分析 A.二氧化硅属于酸性氧化物但和水不反应;
B.碳酸酸性大于硅酸,所以二氧化碳、水和硅酸钠反应生成原硅酸;
C.高温下,二氧化硅与碳酸钠反应放出二氧化碳,不能据此判断硅酸和碳酸的相对强弱;
D.二氧化硅属于酸性氧化物,但能溶于HF.
解答 解:A.二氧化硅属于酸性氧化物但和水不反应,用二氧化硅和NaOH溶液制取硅酸钠,然后用硅酸钠制取硅酸,故A错误;
B.碳酸酸性大于硅酸,所以二氧化碳、水和硅酸钠反应生成原硅酸,故B正确;
C.高温下,二氧化硅与碳酸钠反应放出二氧化碳,因为有高温条件,所以不能据此判断硅酸和碳酸的相对强弱,故C错误;
D.二氧化硅属于酸性氧化物,能溶于强碱溶液,且能溶于HF,所以可以用HF雕刻玻璃,故D错误;
故选B.
点评 本题考查二氧化硅的性质,二氧化硅属于酸性氧化物但能溶于HF,知道制取硅酸的方法,题目难度不大.


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:解答题
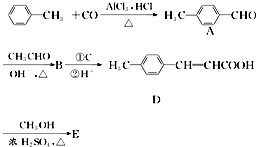
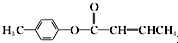 是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为
是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为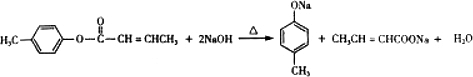 .
.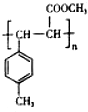 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
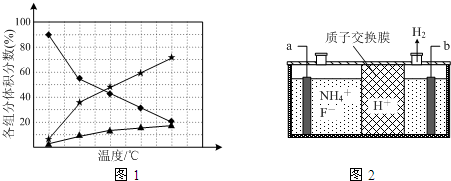
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COONa的溶液:CH3COO-+H2O═CH3COOH+OH- | |
| B. | NH4Cl的溶液:NH4++H2O?NH3•H2O+H+ | |
| C. | Na2CO3的溶液:CO32-+H2O?H2CO3+2OH- | |
| D. | AlCl3的溶液:Al3++3H2O═Al(OH)3↓+3H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
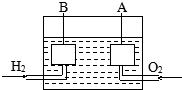 宇宙飞船上使用的氢氧燃料电池是一种新型化学电池,其构造如图所示,A、B是多孔性炭制成的两个电极,通入的气体由孔隙中逸出,并在电极表面放电.
宇宙飞船上使用的氢氧燃料电池是一种新型化学电池,其构造如图所示,A、B是多孔性炭制成的两个电极,通入的气体由孔隙中逸出,并在电极表面放电.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 (1)FeCl3具有净水作用,但腐蚀设备,FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示)2Fe3++Fe=3Fe2+.
(1)FeCl3具有净水作用,但腐蚀设备,FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示)2Fe3++Fe=3Fe2+.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下c(NH4+)相同的下列溶液:①NH4Al(SO4)2②NH4Cl③CH3COONH4,物质的量浓度由大到小的顺序为②>①>③ | |
| B. | 0.001mol•L-1氯水中:c(Cl2)+c(Cl-)+c(ClO-)+c(HClO)=0.01mol•L-1 | |
| C. | amol•L-1的醋酸与0.01mol•L-1的氢氧化钠溶液等体积混合后呈中性,则醋酸的Ka=5×10-10/(a/2-0.005) | |
| D. | 向5mL含KCl和Kl浓度均为0.01mol•L-1的混合溶液中,滴加8mL0.01mol•L-1的AgNO3溶液,所得溶液中离子浓度大小关系为c(NO3-)>c(K+)>c(Cl-)>c(I-)>c(Ag+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com