
A.氯化钡有两性
B.两支试管的沉淀均是亚硫酸钡
C.SO2有还原性和酸性
D.升高pH使SO2水溶液中的![]() 浓度增大
浓度增大
解析:在BaCl2溶液中通入CO2,溶液仍然澄清,这是事实。因此如果反应,BaCl2+SO2+H2O=BaSO3↓+2HCl,一是出现弱酸H2SO3制强盐酸违反反应规律;二是即使生成BaSO3沉淀它也溶于盐酸,故SO2和BaCl2溶液分成两份,一份加硝酸,再通入SO2,可以将SO2和![]() 氧化成
氧化成![]() ,此时生成Ba2++
,此时生成Ba2++![]() =BaSO4↓;另一份加烧碱溶液,再通入SO2,先发生SO2+2NaOH=Na2SO3+H2O,再发生Na2SO3+BaCl2=BaSO3↓+2NaCl。综上所述A、B两项不正确。C中SO2能被硝酸氧化和与NaOH溶液反应证明其有还原性和酸性,故C项正确。D升高pH,可理解为加碱后,SO2生成Na2SO3,当然
=BaSO4↓;另一份加烧碱溶液,再通入SO2,先发生SO2+2NaOH=Na2SO3+H2O,再发生Na2SO3+BaCl2=BaSO3↓+2NaCl。综上所述A、B两项不正确。C中SO2能被硝酸氧化和与NaOH溶液反应证明其有还原性和酸性,故C项正确。D升高pH,可理解为加碱后,SO2生成Na2SO3,当然![]() 浓度加大,故D选项正确。此题设计的意图是考查对SO2性质的把握及能否运用有关规律、技巧解题的能力。
浓度加大,故D选项正确。此题设计的意图是考查对SO2性质的把握及能否运用有关规律、技巧解题的能力。
答案:CD


 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
在BaCl2溶液中通入SO2气体,溶液仍澄清;若将BaCl2溶液分盛在两支试管中,一支加硝酸,另一支加烧碱溶液,然后再通入SO2气体,结果两支试管都有白色沉淀。由此得出下列结论合理的是( )
A.氯化钡有两性
B.两支试管的沉淀均是亚硫酸钡
C.SO2有还原性和酸性
D.升高pH使SO2水溶液中的![]() 浓度增大
浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
在BaCl2溶液中通入SO2气体,溶液仍澄清;若将BaCl2溶液分盛于两支试管,一支加硝酸,另一支加烧碱溶液,然后再通入SO2气体,结果两支试管都有白色沉淀。由此得出下列结论合理的是( )
A.氯化钡有两性 B.两支试管的沉淀均是亚硫酸钡
C.SO2有还原性,是碱性氧化物 D.增强碱性使SO2水溶液中![]() 浓度增大
浓度增大
查看答案和解析>>
科目:高中化学 来源:2012届山东省潍坊市重点中学高三2月月考化学试卷 题型:填空题
(16分)A、B、C、D都是中学化学中的常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如下(部分反应中的水已略去)。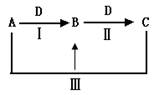
(1)若A是一种强碱,C为厨房中的用品。
①反应Ⅲ的离子方程式是__________________________________。
②下列有关B、C的说法正确的是
A.向B的饱和溶液中通入D,将有晶体析出
B.可以用BaCl2或CaCl2稀溶液或Ba(OH)2稀溶液鉴别B、C两种溶液
C.分别取等质量的B、C两种固体与足量盐酸反应C产生气体多
D.取a克B、C的混合物充分加热,固体质量减重b克,由此可计算出混合物中B的质量分数
E.取a克B、C的混合物与足量稀硫酸充分反应,逸出的气体用碱石灰完全吸收,增重b克, 由此可计算出混合物中B的质量分数
(2)若A、D均为单质,且A为气体,D元素的一种红棕色氧化物常用作颜料。
①反应Ⅲ的离子方程式是__________________________________。
②向沸水中逐滴加入5~6滴B的饱和溶液,继续煮沸至溶液呈红褐色,该反应的化学方程式为: 。区分该分散系与其它分散系最本质的特征是 。
⑶若常温下A、C是气体,B是固体。
①反应Ⅲ的化学方程式是__________________________________.
有两瓶经过C气体和(2)中的A气体漂白的品红溶液,如何通过简单实验进行鉴别?
。
③在BaCl2溶液中通入C气体,未见沉淀生成,若先通入下列的另一种气体,再通入C;或者向通入C气体的BaCl2溶液中加入下列物质,可以看到沉淀的有_______(填序号)。
A、Cl2 B、NH3 C、HCl D、CO2 E、KNO3
查看答案和解析>>
科目:高中化学 来源:2014届广西桂林中学高一下学期期中考试化学试卷(解析版) 题型:选择题
下列有关SO2说法中不正确的是
A.被酸雨污染的农田可洒生石灰粉末,减轻其危害
B.在BaCl2溶液中通入SO2气体,溶液仍澄清,滴入3%过氧化氢溶液有白色沉淀
C.二氧化硫气体能用浓硫酸干燥,说明二氧化硫无还原性
D.二氧化硫能漂白某些物质,加热后可恢复原色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com