
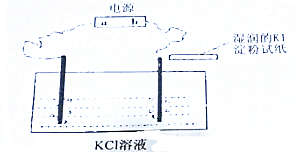
分析 通电源前在KCl溶液中滴入2滴酚酞试液,接通电源后,观察到湿润的KI淀粉试纸变蓝,说明连接b的电极上氯离子放电生成氯气,则该电极是阳极,所以b是正极、a是负极;
(1)该电解池中,一个电极上氯离子放电生成黄绿色气体氯气,一个电极上氢离子放电生成氢气,同时该电极附近生成KOH,溶液呈碱性,酚酞遇碱变红色;
(2)a是负极,阳极上氯离子放电生成氯气;
(3)电解KCl溶液时,阳极上生成氯气、阴极上生成氢气,同时阴极附近生成KOH;
(4)根据氢气和转移电子之间的关系式计算通过电子物质的量.
解答 解:通电源前在KCl溶液中滴入2滴酚酞试液,接通电源后,观察到湿润的KI淀粉试纸变蓝,说明连接b的电极上氯离子放电生成氯气,则该电极是阳极,所以b是正极、a是负极;
(1)该电解池中,一个电极上氯离子放电生成黄绿色气体氯气,一个电极上氢离子放电生成氢气,同时该电极附近生成KOH,溶液呈碱性,酚酞遇碱变红色,所以还看到的现象是:连接a电极的电极上有无色气体生成,且该电极附近溶液呈红色,
故答案为:连接a电极的电极上有无色气体生成;连接a电极的电极附近溶液呈红色;
(2)a是负极,阳极上氯离子放电生成氯气,电极反应式为2Cl--2e-=Cl2↑,
故答案为:负;2Cl--2e-=Cl2↑;
(3)电解KCl溶液时,阳极上生成氯气、阴极上生成氢气,同时阴极附近生成KOH,电池反应式为2KCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2KOH+Cl2↑+H2↑,
故答案为:2KCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2KOH+Cl2↑+H2↑;
(4)n(H2)=$\frac{1.12L}{22.4L/mol}$=0.05mol,根据2H++2e-=H2↑得转移电子物质的量=0.05mol×2=0.1mol,故答案为:0.1mol.
点评 本题考查电解原理,明确正负极、阴阳极的判断是解本题关键,知道各个电极上发生的反应,知道氯气的检验方法,题目难度不大.


科目:高中化学 来源: 题型:解答题
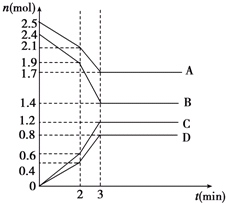 在某一容积为2L的恒容密闭容器中,A、B、C、D四种物质的物质的量n(mol)随时间t(min)的变化曲线如图所示.回答下列问题:
在某一容积为2L的恒容密闭容器中,A、B、C、D四种物质的物质的量n(mol)随时间t(min)的变化曲线如图所示.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
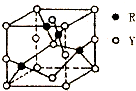 X、Y、Z、R为前四周期元素,原子序数依次增大.X、Y同周期,X基态原子的最外层电子数是次外层的2倍,Y基态原子的s能级和p能级上电子数相等;Z是地壳中含量最高的金属元素; R+离子的3d轨道全充满.请回答下列问题:
X、Y、Z、R为前四周期元素,原子序数依次增大.X、Y同周期,X基态原子的最外层电子数是次外层的2倍,Y基态原子的s能级和p能级上电子数相等;Z是地壳中含量最高的金属元素; R+离子的3d轨道全充满.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
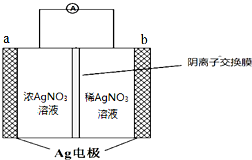 银是一种在工业、生活上有广泛用途的金属.
银是一种在工业、生活上有广泛用途的金属.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14C可用于文物年代的鉴定,14C与12C互为同素异形体 | |
| B. | PM 2.5亦称可入肺颗粒物,分散在空气中形成胶体,能吸附有毒有害物$\frac{2b}{a-2b}$质 | |
| C. | “海水淡化”可以解决“淡水供应危机”,向海水中加入净水剂明矾可以使海水淡化 | |
| D. | 绚丽缤纷的烟花中添加了含钾、钠、钙、钡等金属元素的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
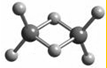 近年来,科学家合成了一系列具有独特化学特性的氢铝化合物(AlH3)n,常用作还原剂 .已知最简单的氢铝化合物的化学式为Al2H6,它的熔点为150℃且熔融状态不能导电,燃烧时放出大量的热量.Al2H6的球棍模型如图所示.下列说法错误的是( )
近年来,科学家合成了一系列具有独特化学特性的氢铝化合物(AlH3)n,常用作还原剂 .已知最简单的氢铝化合物的化学式为Al2H6,它的熔点为150℃且熔融状态不能导电,燃烧时放出大量的热量.Al2H6的球棍模型如图所示.下列说法错误的是( )| A. | Al2H6中Al为-3价,H为+1价 | |
| B. | Al2H6中含有离子键和极性共价键 | |
| C. | Al2H6在固态时所形成的晶体是分子晶体 | |
| D. | Al2H6在空气中完全燃烧,产物为氧化铝和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
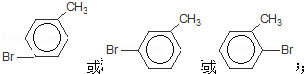
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com