
【题目】下列有关实验装置(夹持和尾气处理装置已省略)进行的相应实验,不能达到实验目的的是

A. 利用甲装置,验证SO2或H2SO3具有氧化性
B. 利用乙装置,验证元素的非金属性:C1>C>Si
C. 利用丙装置,进行NH3的干燥、收集、尾气处理
D. 利用丁装置,验证浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性
 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】毒品冰毒属于芳香族化合物,分子中只含有碳、氢、氮三种元素,相对分子质量不超过150,碳元素和氢元素质量分数之和为90.6%。请按要求填空:
(1)冰毒的摩尔质量为___________,分子式为___________。
(2)冰毒的同分异构体有很多,写出同时符合下列三项要求的冰毒的同分异构体的结构简式。(只要求写出其中的三种)。①苯环上只含有两个相邻的取代基②分子中含有氨基(—NH2)③分子中含有两个甲基(—CH3)____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】毒品冰毒属于芳香族化合物,分子中只含有碳、氢、氮三种元素,相对分子质量不超过150,碳元素和氢元素质量分数之和为90.6%。请按要求填空:
(1)冰毒的摩尔质量为___________,分子式为___________。
(2)冰毒的同分异构体有很多,写出同时符合下列三项要求的冰毒的同分异构体的结构简式。(只要求写出其中的三种)。①苯环上只含有两个相邻的取代基②分子中含有氨基(—NH2)③分子中含有两个甲基(—CH3)____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用化学方程式或离子方程式表示相应的化学反应.
(1)工业生产上将氯气通入石灰乳,在一定条件下蒸干可制漂白粉.写出该过程的化学方程式:___________________________________.
(2)侯氏制碱法中最后利用小苏打固体可以制得纯碱,写出该过程的化学方程式:____.
(3)向水玻璃溶液(Na2SiO3溶液)中,加入稀盐酸可用于生产硅酸胶体.用离子方程式表示该生产原理:________________________________________.
(4)硫酸工业中用氨水吸收二氧化硫,写出氨水吸收过量二氧化硫的离子方程式____.
(5)NO是大气污染物之一,目前一种治理方法是在400℃左右、在催化剂的作用下用氨气还原,写出化学方程式________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为研究乙醇结构及其部分的化学性质,进行下列实验。完成下列问题:
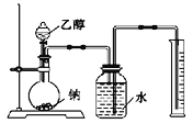
Ⅰ.用如图装置来推测乙醇的结构式。
(1)实验中钠需要粉碎成很小的颗粒,其原因是 _______________________________。
(2)两次实验平均用乙醇1.15g,收集到H2体积平均为0.28L(换算成标准状态)。由实验数据可推测H2来自乙醇分子中________(填名称)的氢原子。
(3)盛装乙醇的玻璃仪器是________________________
Ⅱ.利用下列装置进行乙醇的催化氧化实验,并检验其产物,其中C装置的试管中盛有无水乙醇。(固定和夹持装置已略去)
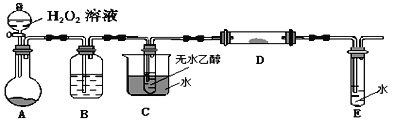
(4)装置A圆底烧瓶内的固体物质是_____,B中的试剂是_____C的作用是______。
(5)本实验中需要加热的装置有_________________ (填装置下的字母)。
(6)写出D处发生反应的化学方程式_________________________________。
(7)检验E中的生成物需要的试剂为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、乙酸,D中放有饱和碳酸钠溶液。

已知:①无水氯化钙可与乙醇形成微溶于水的CaCl2·6C2H5OH;
②有关有机物的沸点:
试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
请回答:
(1)浓硫酸的作用为__________,圆底烧瓶中发生的化学反应方程式:_________。
(2)球形干燥管C的作用是_________,反应结束后D中的现象是_______________。
(3)该小组同学在实验时加入过量的乙醇,目的是_________________。
(4)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出____________;再加入(此空从下列选项中选择)________;然后进行蒸馏,收集77℃左右的馏分,以得到较纯净的乙酸乙酯。
A.五氧化二磷 B.碱石灰 C.无水硫酸钠 D.生石灰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的镁和铜组成的混合物加入到过量的稀硝酸中,金属完全溶解(假设反应中还原产物只有NO)。向反应后的溶液中加入3mol/L NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g。则下列叙述中错误的是
A. 当生成的沉淀量达到最大时,消耗NaOH溶液的体积V=100ml
B. 当金属全部溶解时,参加反应的硝酸的物质的量一定是0.4mol
C. 参加反应的金属的总质量为9.6g>m>3.6g
D. 当金属全部溶解时收集到NO气体的体积在标准状况下一定为2.24L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用。下表列出了12种元素在周期表中的位置。
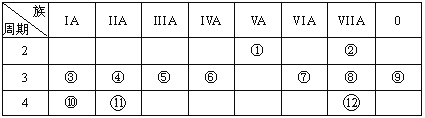
请回答:
(1)写出下列元素名称:①________,⑥________,⑦________。
(2)在①~元素中,金属性最强的元素是___,非金属性最强的素是____,最不活泼的元素是________。(均填元素符号)
(3)元素⑩与水反应的化学方程式__________________________。
(4)②与水的反应方程式______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com