
| A. | SO2可用于杀菌、消毒 | B. | HF可用于雕刻玻璃 | ||
| C. | NH3可用于制硝酸 | D. | SiO2可用于制太阳能电池 |
分析 A.病毒属于蛋白质,能被二氧化硫杀死而发生蛋白质变性;
B.HF能与玻璃中的二氧化硅反应;
C.氨气催化氧化生成一氧化氮,一氧化氮氧化生成二氧化氮,二氧化氮与水反应生成硝酸;
D.二氧化硅为绝缘体.
解答 解:A.二氧化硫有毒,能被二氧化硫杀死而发生蛋白质变性,可用于工业上杀菌消毒,但是不能用食品杀菌消毒,故A正确;
B.HF能与玻璃中的二氧化硅反应,可以腐蚀玻璃,用于雕刻玻璃,故B正确;
C.氨气催化氧化生成一氧化氮,一氧化氮氧化生成二氧化氮,二氧化氮与水反应生成硝酸,故C正确;
D.二氧化硅为绝缘体,不导电,用于制造太阳能电池为硅,故D错误;
故选:D.
点评 本题考查了元素化合物知识,侧重考查物质的用途,熟悉相关物质的性质是解题关键,注意二氧化硅与硅性质与用途区别,题目难度不大.


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ②③⑤ | C. | ②⑤⑥ | D. | ①④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴乙烷和乙酸乙酯 | B. | 乙醇和乙酸 | ||
| C. | 乙醇和乙酸乙酯 | D. | 苯乙烯和氯甲烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④⑥⑧ | B. | ①④⑥⑧ | C. | ①④⑤⑥⑦ | D. | ②⑤⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
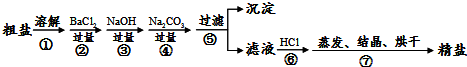
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
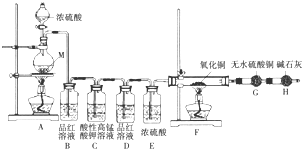
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
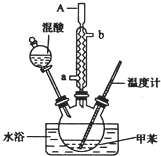 一硝基甲苯是一种重要的工业原料,某化学学习小组设计如图所示装置制备一硝基甲苯(包括对硝基甲苯和邻硝基甲苯).反应原理:
一硝基甲苯是一种重要的工业原料,某化学学习小组设计如图所示装置制备一硝基甲苯(包括对硝基甲苯和邻硝基甲苯).反应原理:
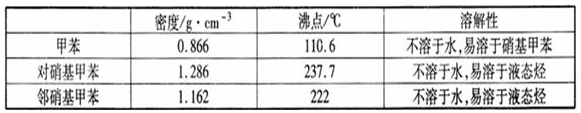
 .
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com