
| A、Mg、Ca、Ba |
| B、I、Br、Cl |
| C、O、Na、S |
| D、Al、Si、P |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
 ③(CH3)3C-CH2Cl ④CH3Cl2⑤
③(CH3)3C-CH2Cl ④CH3Cl2⑤ ⑥CHCl2-CHBr.
⑥CHCl2-CHBr.| A、①③④ | B、②③⑤ |
| C、全部 | D、②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酸:电离产生的阳离子是否全部是氢离子 |
| B、化学平衡状态:正逆反应的反应速率是否等于0 |
| C、共价化合物:组成物质的元素是否全部是非金属元素 |
| D、化学变化:是否有热效应、颜色变化、气体或沉淀生成等实验现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(Fe3+)=0.l mol?L-1的溶液中K+、NH4+、SCN-、SO42- |
| B、水电离出的c(OH-)=1.0×10-13mo1?L-1的溶液:Na+、K+、MnO4-、Cr2O72- |
| C、能与铝反应生成氢气的溶液中:K+、C1-、Na+、SiO32- |
| D、0.1mol?L-1 NaOH溶液K+、Na+、SO42-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
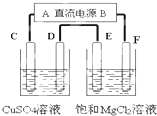 如图所示的装置,C、D、E、F都是惰性电极.将电源接通后,向1mol/L的MgCl2溶液中滴入酚酞溶液,在F极附近显红色.则以下说法正确的是( )
如图所示的装置,C、D、E、F都是惰性电极.将电源接通后,向1mol/L的MgCl2溶液中滴入酚酞溶液,在F极附近显红色.则以下说法正确的是( )| A、电源A极是负极 |
| B、左烧杯内溶液的pH减小,右烧杯有白色浑浊出现 |
| C、电极D是阳极,发生的电极反应为:4OH-+4e-═2H2O+O2 |
| D、C﹑D﹑E﹑F电极均有单质生成,其物质的量之比为2:1:1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下将铝和铜用导线连接组成原电池放入到氢氧化钠溶液中 |
| B、常温下将铝和铜用导线连接组成原电池放入到稀盐酸溶液中 |
| C、与氯气反应时,铝失去3个电子,而铜失去2个电子 |
| D、常温下,铝在浓硝酸中钝化而铜不发生钝化 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| t1~t2 | t2~t3 | t3~t4 | t4~t5 | t5~t6 |
| K1 | K2 | K3 | K4 | K5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com