
| A. | AY溶液的pH小于7 | |
| B. | AY溶液的pH小于BY溶液的pH | |
| C. | 稀释相同倍数,BX溶液的pH变化小于BY溶液 | |
| D. | 电离平衡常数K(BOH)小于K(HY) |
分析 AX的溶液pH=7且溶液中c(X-)=1mol/L,说明HX为强酸,AOH为强碱,BX的溶液pH=4,BY的溶液pH=6.溶液呈酸性,说明HY为弱酸,BOH为弱碱,依据判断的结果分析选项判断.
解答 解:A.依据判断AOH为强碱,HY为弱酸,AY溶液为强碱弱酸盐溶液的pH大于7,故A错误;
B.AOH为强碱,HY为弱酸,AY溶液为强碱弱酸盐,溶液PH>7;BY的溶液pH=6.溶液呈酸性,所以AY溶液的pH值大于BY的pH,故B错误;
C.BX溶液的pH=4,BY溶液的pH=6,前者水解程度大于后者,加水促进水解,稀释相同倍数溶液pH值变化BX大于BY,故C错误;
D.AX的溶液pH=7且溶液中c(X-)=1mol/L,说明HX为强酸,AOH为强碱,BX的溶液pH=4,BY的溶液pH=6.溶液呈酸性,说明HY为弱酸,BOH为弱碱,所以电离平衡常数K(BOH)<K(HY),故D正确;
故选D.
点评 本题考查了弱电解质电离平衡,侧重于学生的分析能力的考查,为高频考点,注意把握盐类水解的溶液酸碱性的判断,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
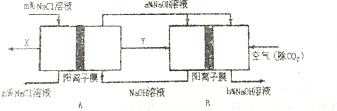
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)═2H2O(l) | B. | H2(g)+Cl2(g)═2HCl(g) | ||
| C. | (NH4 )2 CO3(s)═NH4HCO3(s)+NH3(g) | D. | Cu(s)+Cl2(g)═CuCl2(s) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


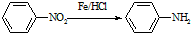 (苯胺,易被氧化)
(苯胺,易被氧化) ,F→G的反应类型是氧化反应.
,F→G的反应类型是氧化反应. .
. 的同分异构体的结构简式
的同分异构体的结构简式 .(写出2种)
.(写出2种) ,请设计合成路线,要求不超过4步(无机试剂任选).注:合成路线的书写格式参照如下示例流程图:CH3CHO$→_{催化剂}^{O_{2}}$CH3COOH$→_{浓H_{2}SO_{4}}^{CH_{3}CH_{2}OH}$CH3COOCH2CH3.
,请设计合成路线,要求不超过4步(无机试剂任选).注:合成路线的书写格式参照如下示例流程图:CH3CHO$→_{催化剂}^{O_{2}}$CH3COOH$→_{浓H_{2}SO_{4}}^{CH_{3}CH_{2}OH}$CH3COOCH2CH3.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
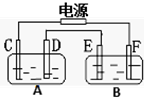
| A. | A池为电解池,B池为原电池 | B. | D、E两极都发生氧化反应 | ||
| C. | F极应为纯铜板材料 | D. | B池中E极质量增加12.8g |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com