
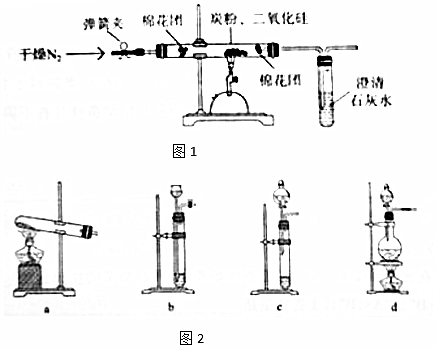
分析 (1)根据假设①②可以得出假设③的内容;
(3)氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应制得氮气,固体和液体加热制备气体选择发生装置,反应物有NH4Cl和NaNO2,生成物为N2;
(4)①按上图连接装置,并检查装置的气密性;
④根据前后两次通入氮气的时间和减小实验误差角度来分析;
⑤洗涤沉淀在过滤器中进行,称量固体质量最少两次,通过两次称量差不超过0.1g判断称量是否准确;
(5)根据质量守恒判断气体的组成,根据质量关系计算气体的物质的量之间的关系,进而书写化学方程式;
(6)一氧化碳是一种有毒气体,可以通过点燃来进行尾气处理.
解答 解:(1)过量炭粉与氧化铁反应的气体产物可能有:①CO、②CO2、③CO2、CO的混合物,
故答案为:CO2、CO的混合物;
(3)氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应制得氮气,固体和液体加热制备气体选择发生装置d,反应物有NH4Cl和NaNO2,生成物为N2,根据质量守恒还应用水,则反应的化学方程式为NH4Cl+NaNO2$\frac{\underline{\;\;△\;\;}}{\;}$N2↑+2H2O+NaCl,
故答案为;d; NH4Cl+NaNO2$\frac{\underline{\;\;△\;\;}}{\;}$N2↑+2H2O+NaCl;
(4)①连接好装置后,称取12.0g二氧化硅,10.0g碳粉混合均匀,放入质量为48.0g的硬质玻璃管中.放入药品前应进行的操作是:检查装置的气密性,
故答案为:检查装置的气密性;
④待反应结束,停止加热,再缓缓通入一段时间的氮气,冷却至室温,称得硬质玻璃管和固体总质量为60.0g.再缓缓通入氮气的作用为:赶出实验产生的CO2,确保CO2完全吸收,
故答案为:赶出实验产生的CO2,确保CO2完全吸收;
⑤将石灰水过滤、洗涤、烘干,称量固体质量为10.0g.该操作中过滤、洗涤时用到的玻璃仪器是烧杯、漏斗、玻璃棒,至少称量2次,
故答案为:烧杯、漏斗、玻璃棒; 2;
(5)12.0g二氧化硅的物质的量为=$\frac{12.0g}{60g/mol}$=0.2mol,澄清石灰水变浑浊,说明有CO2气体生成,
则n(CO2)=n(CaCO3)=$\frac{10g}{100g/mol}$=0.1mol,m(CO2)=0.1mol×44g/mol=4.4g,
反应后硬质玻璃管和固体总质量变化=12g+10g+48g-60g=10g大于4.4g,则生成其气体为CO2、CO的混合物,混合气体中含有CO物质的量=$\frac{10g-4.4g}{28g}$=0.2mol,所以CO、CO2的混合气体物质的量比为2:1,所以方程式为:3C+2SiO2$\frac{\underline{\;高温\;}}{\;}$2Si+2CO↑+CO2↑,
故答案为:3C+2SiO2$\frac{\underline{\;高温\;}}{\;}$2Si+2CO↑+CO2↑;
(6)一氧化碳是一种有毒气体,可以通过点燃来进行尾气处理,故答案为:在尾气出口处加一点燃的酒精灯.
点评 本题考查物质的制备,为高考常见题型和高频考点,侧重于学生的分析能力、实验能力的考查,注意把握题给信息,结合物质的性质解题,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在空气质量日报中CO2含量属于空气污染指数 | |
| B. | 日常生活中和医院常用无水乙醇杀菌消毒 | |
| C. | 绿色食品是指不含任何化学物质的食品 | |
| D. | 目前加碘食盐中主要添加的是KIO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
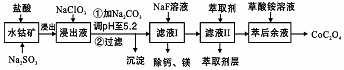
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaO | B. | Na2CO3 | C. | SiO2 | D. | CaCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
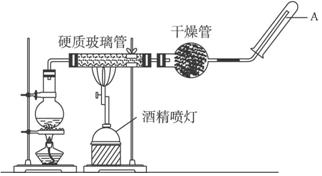 在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应.
在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
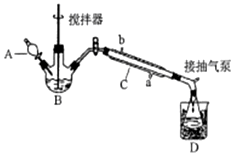 过氧乙酸(
过氧乙酸( 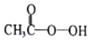 )是一种常见消毒剂,具强氧化性,减压蒸馏法制备过氧乙酸的步骤及装置如图:
)是一种常见消毒剂,具强氧化性,减压蒸馏法制备过氧乙酸的步骤及装置如图:| 反应物比例 CH3COOH/H2O2 | 反应时间(小时) | ||||
| 0.5 | 1 | 3 | 5 | 7 | |
| 2:1 | 7.38 | 8.46 | 9.42 | 11.26 | 13.48 |
| 1:1 | 10.56 | 12.92 | 13.54 | 20.72 | 20.70 |
| 1:2 | 6.14 | 7.10 | 7.96 | 10.38 | 12.36 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2个-CH3,能生成3种一氯代物 | B. | 3个-CH3,能生成3种一氯代物 | ||
| C. | 3个-CH3,能生成2种一氯代物 | D. | 4个-CH3,能生成2种一氯代物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com