
����Ŀ������������(Na2S2O5)�dz��õ������������Ʊ���������Na2CO3��Һ��ͨ��SO2������NaHSO3��CO2��һ��������NaHSO3ת��ΪNa2S2O5������������:
��1��̼ԭ�ӵ�ԭ�ӽṹʾ��ͼ��_____________��CO2�Ļ�ѧ������_______________________��
��2����ԭ�ӽṹ�ĽǶȣ�������Ԫ�صķǽ����Ա���Ԫ��ǿ��ԭ��______________________��
��3��SO2��Na2CO3��Һ��Ӧ����NaHSO3��CO2���仯ѧ����ʽΪ_____________________��֤��NaHSO3��Һ��HSO3-�ĵ���̶ȴ���ˮ��̶ȣ��ɲ��õ�ʵ�鷽����________________��
��4��Na2S2O5��������ʱ�ķ�Ӧԭ��ΪNa2S2O5+O2+H2O��Na2SO4+H2SO4���÷�Ӧ�У�����������_____������Ӧ��ת����0.04mol�ĵ��ӣ���____g Na2S2O5�μӷ�Ӧ��
��5��������������Na2S2O4�׳Ʊ��շۣ��㷺���ڷ�֯��ҵ�Ļ�ԭ��Ⱦɫ����ϴ��ӡ������ɫ�Լ�֯���Ư����Na2S2O4����ǿ��ԭ������¶�ڿ������ױ�����������Na2S2O4��KMnO4������Һ������Ӧ:
5Na2S2O4+6KMnO4+4H2SO4=5Na2SO4+3K2SO4+6MnSO4+4H2O��Ϊ�˲ⶨ���շ۴��ȡ���ȡ5.0g Na2S2O4��Ʒ������ˮ�У����100mL��Һ��ȡ��10mL����Һ����ƿ�У���0.1000mol/L��KMnO4��Һ�ζ����ظ���������2�Σ�ƽ������KMnO4��Һ21.00mL�������Ʒ��Na2S2O4����������Ϊ________(���ʲ����뷴Ӧ)��(������0.1%)
���𰸡� ![]() ���Թ��ۼ� ��ԭ�Ӻ���ԭ��������������ȣ�������ԭ�ӵİ뾶����ԭ��С���˶Ժ�����ӵ�������ǿ���õ�������ǿ��������Ԫ�طǽ����Ա���ǿ 2SO2+Na2CO3+H2O=2NaHSO3+CO2 ȡ�����ⶨ��Һ��pH����pHС��7��˵������̶ȴ���ˮ��̶� Na2SO4��H2SO4 1.90 60.9%
���Թ��ۼ� ��ԭ�Ӻ���ԭ��������������ȣ�������ԭ�ӵİ뾶����ԭ��С���˶Ժ�����ӵ�������ǿ���õ�������ǿ��������Ԫ�طǽ����Ա���ǿ 2SO2+Na2CO3+H2O=2NaHSO3+CO2 ȡ�����ⶨ��Һ��pH����pHС��7��˵������̶ȴ���ˮ��̶� Na2SO4��H2SO4 1.90 60.9%
����������1��̼ԭ�Ӻ˵����Ϊ6��,ԭ�ӽṹʾ��ͼ��![]() ��CO2Ϊ���ۻ�������̼��ԭ�Ӽ��γ�2�����ۼ�������̼��ԭ�ӵĵ縺�Բ�ͬ������CO2�����ڻ�ѧ������Ϊ���Թ��ۼ�����ȷ����
��CO2Ϊ���ۻ�������̼��ԭ�Ӽ��γ�2�����ۼ�������̼��ԭ�ӵĵ縺�Բ�ͬ������CO2�����ڻ�ѧ������Ϊ���Թ��ۼ�����ȷ���� ![]() �� ���Թ��ۼ���
�� ���Թ��ۼ���
��2����Ȼ��ԭ�Ӻ���ԭ��������������ȣ�������ԭ�ӵİ뾶����ԭ��С���˶Ժ�����ӵ�������ǿ���õ�������ǿ��������Ԫ�طǽ����Ա���ǿ����ȷ������ԭ�Ӻ���ԭ��������������ȣ�������ԭ�ӵİ뾶����ԭ��С���˶Ժ�����ӵ�������ǿ���õ�������ǿ��������Ԫ�طǽ����Ա���ǿ��
��3������������Դ���̼�ᣬSO2��Na2CO3��Һ��Ӧ����NaHSO3��CO2���仯ѧ����ʽΪ2SO2+Na2CO3+H2O=2NaHSO3+CO2��HSO3-�ĵ��������Һ��������HSO3-��ˮ�������Һ�Լ�����Ҫ֤��HSO3-�ĵ���̶ȴ���ˮ��̶ȣ��Ϳ���֤������Һ�����Լ�����ʵ�鷽����ȡ������pH��ֽ�ⶨ��Һ��pH����pHС��7��˵������̶ȴ���ˮ��̶�����ȷ����2SO2+Na2CO3+H2O=2NaHSO3+CO2��ȡ�����ⶨ��Һ��pH����pHС��7��˵������̶ȴ���ˮ��̶���
��4��Na2S2O5����Ԫ��Ϊ+4����������ΪNa2SO4��H2SO4��SO2-4�����Ϊ+6�ۣ��������������Na2SO4��H2SO4����1mol�����õ��ӱ�Ϊ-2�۵�����֪���÷�Ӧת�Ƶ���4mol�����ݷ�Ӧ��ϵ��֪��Na2S2O5--O2-4e-������Ӧ��ת����0.04mol�ĵ���������Na2S2O5����Ϊ0.01mol������Ϊ190��0.01=1.9 g����ȷ����Na2SO4��H2SO4��1.90��
��5��Na2S2O4��KMnO4������Һ������Ӧ����Na2SO4��K2SO4��MnSO4������Ԫ�ع�����6��,��Ԫ�ع�����5��,���ϼ�����Ӧ��ͬ,�ʹ�ϵΪ��5S2O42----6MnO4- ,10mL��Һ������KMnO4����Ϊ21��10-3��0.1mol,��100mL��Һ����KMnO4����Ϊ21��10-3��0.1��10mol,�ɴ˿�֪��Ʒ��Na2S2O4����Ϊ5/6��21��10-3��0.1��10mol=0.0175 mol, Na2S2O4������Ϊ0.0175��174 g������Ʒ��Na2S2O4����������Ϊ0.0175��174/5��100%= 60.9%����ȷ����60.9%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ��ش��������⣺
��1����֪��������ȼ���Ȧ�H=-285.8 kJ/mol��������ȼ�յ��Ȼ�ѧ����ʽ�ɱ�ʾΪ_____��
��2����ͼ��ʾ��101kPaʱ������������ȼ�������Ȼ�������������仯���˷�Ӧ���Ȼ�ѧ����ʽΪ________________��
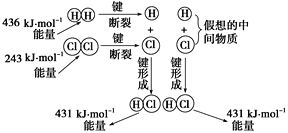
��3����֪��1 molˮ�������Һ̬ˮ����44 kJ����ϱ��⣨1������2����Ϣ����֪��4HCl(g)��O2(g)![]() 2Cl2(g)��2H2O(g)����H��________ kJ/mol��
2Cl2(g)��2H2O(g)����H��________ kJ/mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ʊ������飨CH3CH2Cl������÷�����
A.������������ӦB.��ϩ�������ӳ�
C.��ϩ���Ȼ���ӳ�D.��ϩ�������ӳɺ�����������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ŀǰ���緶Χ�ڵ���ԴΣ�����״���Ϊһ�ֽϺõĿ�������Դ�����й㷺��Ӧ��ǰ����
��1����֪�ڳ��³�ѹ�·�Ӧ���Ȼ�ѧ����ʽ��
��CO(g)��2H2(g) ![]() CH3OH(g) ��H1����90 kJ��mol��1
CH3OH(g) ��H1����90 kJ��mol��1
��CO(g)��H2O(g) ![]() CO2(g)��H2(g) ��H2����41 kJ��mol��1
CO2(g)��H2(g) ��H2����41 kJ��mol��1
д���ɶ�����̼�������Ʊ��״����Ȼ�ѧ����ʽ��_______________________��
��2�����ݻ�ΪV L�������г���a mol CO��2a mol H2���ڴ��������·�Ӧ���ɼ״���ƽ��ʱ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��ʾ��
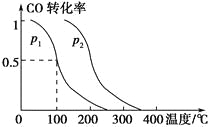
��p1________p2(����������������������������)��
�����¶Ⱥ��ݻ����������£�������a mol CO��2a mol H2���ﵽ��ƽ��ʱ��CO��ת����________(����������������С����������������ͬ)��ƽ�ⳣ��________��
��3������CO(g)��2H2(g) ![]() CH3OH(g) ��H1����90 kJ��mol��1 ��ȷ����_____________________
CH3OH(g) ��H1����90 kJ��mol��1 ��ȷ����_____________________
A.�¶Ⱥ�ѹǿһ��ʱ�����������ܶȲ��ٱ仯��֤���Ѿ��ﵽƽ��״̬
B. 2V��CO����= V��H2����
C.�¶Ⱥ����һ��ʱ��������ѹǿ���䣬֤���Ѿ��ﵽƽ��״̬
D.�ٷֱ����2W(CO)=W(H2)��֤���Ѿ��ﵽƽ��״̬
E.��������ƽ����Է����������ٸı��״̬��֤���Ѿ��ﵽƽ��״̬
F.�¶�Խ��Խ�����ڸ÷�Ӧ�Է�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڰ������ʵ������У�����ȷ���ǣ� ��
A.��ɫ���д̼�����ζ����
B.��������ˮ
C.��ͬ�����£��ܶȱȿ����Ĵ�
D.����ˮ��Ӧ���ɼ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���F( )Ϊһ�ָ߷�����֬������C�ķ���ʽΪ:C10H10Obr2��F�ĺϳ�·������:
)Ϊһ�ָ߷�����֬������C�ķ���ʽΪ:C10H10Obr2��F�ĺϳ�·������:

��֪:��AΪ����ȩ��ͬϵ���������������Է�������Ϊ134��
��
��ش���������:
��1��X�Ļ�ѧ������_____________________________________��
��2��E����F�ķ�Ӧ����Ϊ___________________________________��
��3��D�Ľṹ��ʽΪ________________________________��
��4����B����C�Ļ�ѧ����ʽΪ______________________________________��
��5�������廯����Y��D��ͬϵ�Y��ͬ���칹�����뱥��Na2CO3��Һ��Ӧ�ų����壬������ֻ��1���������˴Ź���������ʾ��5�ֲ�ͬ��ѧ�������⣬��ֵ�����Ϊ6:2:2:1:1��д�����ַ���Ҫ���Y�Ľṹ��ʽ____________��________________________��
��6��д���Լ�ȩ����ȩ���Ҷ���Ϊ��Ҫԭ�Ϻϳ����������۾��߷��Ӳ���-�ۼ���ϩ��������( )�ĺϳ�·��(���Լ���ѡ):__________________________��
)�ĺϳ�·��(���Լ���ѡ):__________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������ͷ�չ�����ʻ���������ʹ�ò��Ͽ��Ը���������������йز��ϵ�˵������ȷ����
A. �ޡ��顢˿��ë���ϳ���ά��ȫȼ�ն�ֻ����C02��H20
B. �������϶��ǵ��壬�ǽ������϶��Ǿ�Ե��
C. ��Ȼ��ͨ��������ǿ�Ⱥ͵���
D. �����ǻ����,�й̶����۵�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ���ҿ�������������������Ҵ��Ʊ�1,2-�������顣�Ʊ�װ������ͼ��

����˵���в���ȷ���ǣ� ��
A. ʹ�ú�ѹ��Һ©����Ŀ���Ƿ�ֹ�л���ӷ���ʹ©����Һ��˳������
B. ʵ����Ϊ�˷�ֹ�л�������ӷ���Ӧ�������߷�Ӧ�¶ȵ�170��
C. װ��C ��Ӧ��������������Һ�������շ�Ӧ�п������ɵ���������
D. ʵ�������Ӧ����ˮ��ȴװ��D���Ա�����Ĵ����ӷ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ���й����ʵĵ���ƽ�ⳣ�����£�
��ѧʽ | CH3COOH | H2CO3 | H2SO3 |
����ƽ�ⳣ�� | K=1.8��10��5 | K1=4.3��10��7 K2=5.6��10��11 | K1=1.5��10��2 K2=1.02��10��7 |
(1)��д��H2SO3�ĵ���ƽ�ⳣ��K1�ı���ʽ��________________��
(2) �����£������Ϊ10mL pH=2�Ĵ�����Һ����������Һ�ֱ������ˮϡ����1000mL��ϡ�ͺ���Һ��pH��ǰ��_____���ߣ����������������=������
(3)һ�������£��������ˮϡ��������Һ��������I���ˮ���V�仯��������ͼ��ʾ����a��b��c������Һ����ĵ���̶��ɴ�СΪ____________________��

(4)��������CH3COO����CO32����HSO3����SO32������Һ�н��H���������ɴ�С�Ĺ�ϵΪ___________��
(5)�����ͬ��c(H��)��ͬ�Ģ�CH3COOH����HCl����H2SO4 ��������Һ�ֱ���ͬŨ�ȵ�NaOH��Һ��ȫ�к�ʱ������NaOH��Һ������ɴ�С������˳����_____(�����)��
(6)��֪��H��(aq) + OH��(aq) == H2O(l) ��H =��57.3 kJ/mol��ʵ����ϡ������ϡNaOH��Һ��Ӧ����1 mol H2Oʱ�ų�57 kJ���ȣ��������Һ�У����������Ȼ�ѧ����ʽΪ________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com