
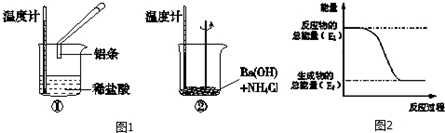
分析 (1)化学反应中,温度升高,则反应放热;温度降低则反应吸热;图2中反应物总能量大于生成物总能量,该反应为放热反应,据此进行解答;
(2)酸碱中和、活泼金属与酸的反应为放热反应;
(3)①自发进行的放热的氧化还原反应能设计成原电池;
②该原电池中,失电子的金属单质作负极,不如Cu活泼的金属或导电的非金属性作正极,电解质溶液为可溶性的氯化铁溶液,负极上Cu失电子发生氧化反应、正极上铜离子得电子发生还原反应.
解答 解:(1)Al与HCl反应后,温度升高,则说明反应放热,Ba(OH)2•8H2O与NH4Cl的反应温度降低,说明反应为吸热反应;
反应①为放热反应,反应物的总能量大于生成物的总能量,所以①的能量变化可用图2表示;
故答案为:放;吸;①;
(2)酸碱中和、活泼金属与酸的反应为放热反应,BF为放热反应,ACE为吸热反应,D不是化学反应,故答案为:BF;
(3)①自发进行的放热的氧化还原反应能设计成原电池,A反应中没有电子转移,不属于氧化还原反应,所以不能设计成原电池;B属于自发进行的放热的氧化还原反应,所以能设计成原电池,
故答案为:B;
②该原电池中,Cu失电子作负极,不如Cu活泼的金属或导电的非金属性作正极,电解质溶液为可溶性的氯化铁溶液,正极上铜离子得电子发生还原反应,电极反应式为:2Fe3++2e-=2Fe2+,负极上Cu失电子发生氧化反应,电极反应式为:Cu-2e-═Cu2+;
故答案为:2Fe3++2e-=2Fe2+;Cu-2e-=Cu2+.
点评 本题考查学生根据实验现象判断放热与吸热反应,原电池设计,难度不大,侧重于基础知识的考查,注意把握实验原理.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:多选题
| A. | HClO的结构式:H-O-Cl | B. | 纯碱的化学式为:Na2CO3 | ||
| C. | 原子核内有8个中子的碳原子148C | D. | Na2O2电子式为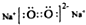 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X与Y形成化合物时,X显负价,Y显正价 | |
| B. | 电负性X>Y | |
| C. | 最高价含氧酸的酸性:X对应的酸性弱于Y对应的酸性 | |
| D. | 失去第一个电子消耗能量:X>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯和甲苯都能使酸性KMnO4溶液褪色 | |
| B. | 氯乙烯、聚乙烯、苯乙烯都是不饱和烃 | |
| C. | CH2=CH2和CH3CH2Cl都属于烃 | |
| D. | C2H4和C4H8一定都能使溴水褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

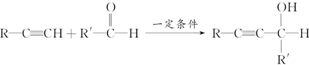
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com