
【题目】Ⅰ.如图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U形管中.

(1)仅K1闭合,石墨棒周围溶液pH升高,其电极反应式为___________________.
(2)仅K2闭合,在铁棒附近滴加酚酞显红色,理由是______________________(用平衡移动原理解释).
(3)仅K2闭合,发生总反应的离子方程式为________________________________.
Ⅱ. 海水的综合利用可以制备金属镁和精盐,其流程如图所示:
(1)步骤a中,溶解、过滤、蒸发三个阶段都要用到的一种玻璃仪器是________.
(2)为使母液中的Mg2+完全转化为Mg(OH)2(离子浓度小于10﹣5molL﹣1时,沉淀就达完全),步骤b中溶液的pH至少要控制在___________.(常温下,Mg(OH)2的Ksp=1×10﹣11)
(3)步骤c必须在氯化氢气体的氛围中加热蒸发才能完成,试用化学方程式表示在无氯化氢的情况下不能生成无水MgCl2的原理_________________________________.
(4)完成步骤d的化学方程式____________________________.
【答案】 O2+4e﹣+2H2O=4OH﹣ H2OH++OH﹣,由于2H++2 e﹣=H2↑,使平衡正向移动,结果c(H+)<c(OH﹣) 2Cl﹣+2H2O ![]() Cl2↑+H2↑+2OH﹣ 玻璃棒 11 MgCl2+2H2O=Mg(OH)2↓+2HCl↑ MgCl2(熔融)
Cl2↑+H2↑+2OH﹣ 玻璃棒 11 MgCl2+2H2O=Mg(OH)2↓+2HCl↑ MgCl2(熔融) ![]() Mg+Cl2↑
Mg+Cl2↑
【解析】Ⅰ.(1)K1闭合构成原电池,铁棒是负极,铁失去电子,石墨棒是正极,溶液中的氧气得到电子转化为OH-,石墨棒周围溶液pH逐渐升高,其电极反应式为:O2+4e﹣+2H2O=4OH﹣;(2)仅K2闭合构成电解池,铁棒与电源的负极相连,作阴极,溶液中的水电离(H2OH++OH﹣)氢离子放电生成氢气,使平衡正向移动,结果c(H+)<c(OH﹣),溶液呈碱性,故在铁棒附近滴加酚酞显红色;(3)仅K2闭合构成电解池,铁棒与电源的负极相连,作阴极,溶液中的氢离子放电生成氢气。石墨棒是阳极,溶液中的氯离子放电生成氯气,故发生总反应的离子方程式为:2Cl﹣+2H2O ![]() Cl2↑+H2↑+2OH﹣ ;Ⅱ. (1)玻璃棒在溶解、过滤、蒸发三个阶段都要用到,故答案为玻璃棒;(2)
Cl2↑+H2↑+2OH﹣ ;Ⅱ. (1)玻璃棒在溶解、过滤、蒸发三个阶段都要用到,故答案为玻璃棒;(2)![]() ,常温下,Kw=1×10-14,
,常温下,Kw=1×10-14,![]() ,故使母液中的Mg2+完全转化为Mg(OH)2(离子浓度小于10﹣5molL﹣1时,沉淀就达完全),步骤b中溶液的pH至少要控制在11;(3)氯化镁为强酸弱碱盐,能发生水解反应:MgCl2+2H2O=Mg(OH)2+2HCl,加热将会促进Mg2+水解和盐酸中的HCl挥发,使平衡向正反应方向进行,故不在氯化氢气流中加热氯化镁的方程式为:MgCl2+2H2O=Mg(OH)2↓+2HCl↑;(4)制备金属镁采用电解法,故步骤d的化学方程式为:MgCl2(熔融)
,故使母液中的Mg2+完全转化为Mg(OH)2(离子浓度小于10﹣5molL﹣1时,沉淀就达完全),步骤b中溶液的pH至少要控制在11;(3)氯化镁为强酸弱碱盐,能发生水解反应:MgCl2+2H2O=Mg(OH)2+2HCl,加热将会促进Mg2+水解和盐酸中的HCl挥发,使平衡向正反应方向进行,故不在氯化氢气流中加热氯化镁的方程式为:MgCl2+2H2O=Mg(OH)2↓+2HCl↑;(4)制备金属镁采用电解法,故步骤d的化学方程式为:MgCl2(熔融) ![]() Mg+Cl2↑。
Mg+Cl2↑。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】铁、钴(Co)、镍(Ni)是同族元素,都是较活泼的金属,它们的化合物在工业上有重要的应用。
(1)Fe2(SO4)3和明矾一样也具有净水作用,其净水的原理是__________________(用离子方程式表示)。
(2)已知某溶液中,Co2+、Ni2+的浓度分别为0.6 mol/L和1.2 mol/L ,取一定量的该溶液,向其中滴加NaOH溶液,当Co(OH)2开始沉淀时,溶液中![]() 的值等于_____。
的值等于_____。
(已知Ksp[Co(OH)2]=6.0×10-15,Ksp[Ni(OH)2]=2.0×10-15)
(3)高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,且不会造成二次污染。
已知高铁酸盐热稳定性差,工业上用湿法制备K2FeO4的流程如下图所示:

①上述氧化过程中,发生反应的离子方程式是: _________________________,
在实际生产中一般控制反应温度30℃以下,其原因是:
________________________________________________________。
②反应③加入浓KOH溶液可析出高铁酸钾(K2FeO4),这说明________________。
③某温度下,将Cl2通入NaOH溶液中,反应后得到NaCl、NaClO、NaClO3的混合溶液, 经测定ClO-与ClO3-离子的物质的量之比是1:2,则Cl2与氢氧化钠反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为______________。
(4)工业上还可用通过电解浓NaOH溶液制备Na2FeO4,其工作原理如下图所示:阳极的电极反应式为___________________;其中可循环使用的物质____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物G是合成维生素类药物的中间体,其结构简式为:
 。
。
G的合成路线如下: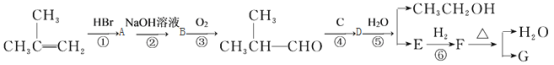
其中A~F分别代表一种有机化合物,合成路线中部分产物及反应条件已略去
已知:

请回答下列问题:
(1)A的结构简式是 , C的结构简式是
(2)D中官能团的名称是
(3)第③步反应的化学方程式是 。
(4)第①~⑥步反应中属于加成反应的有 (填步骤编号)。
(5)同时满足下列条件的E的同分异构体有 种。
①只含一种官能团;②链状结构且无—O—O—;③核磁共振氢谱只有两种峰。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是( )
A. 溴水中当加入硝酸银溶液后,溶液颜色变浅 B. 高压比常压有利于工业合成氨反应
C. 红棕色NO2加压后颜色比原来要深 D. 热的纯碱除油污效果好
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关实验室制备乙酸乙酯和乙酸丁酯的描述错误的是
A. 两反应均需使用浓硫酸、乙酸
B. 过量乙酸可提高1-丁醇的转化率
C. 制备乙酸乙酯时乙醇应过量
D. 提纯乙酸丁酯时,需过滤、洗涤等操作
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用正确的化学用语表达
(1)写出N2的结构式:____。
(2)写出1,2-二溴乙烷的结构简式:____。
(3)写出铜与氯化铁溶液反应的离子方程式: ____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 2011年4月台湾曝出的增塑剂风波一度让人们“谈塑色变”。常用的增塑剂如下:

请回答下列问题:
(1)下列对甲的叙述正确的是 (填选项字母)
A.甲能使Br2的CCl4溶液退色
B.甲的单体是CH3CH = CHCOOCH2CH2CH3
C.1 mol甲能与1 mol NaOH发生水解反应
D.甲能发生酯化反应、取代反应、消去反应、加成反应
(2)丙中含有的官能团名称是 。
(3)乙的同分异构体有多种,写出其中一种不含甲基的羧酸的结构简式 。
(4)已知通过燃烧法确定丁的含氧量(质量分数)为23%。以某烃A为原料合成该塑料增塑剂的流程如下:

①反应1的反应条件是 。
②反应2的反应类型是 。
③反应3的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机物的说法不正确的是
A. 淀粉水解可以制取葡萄糖 B. 2-甲基丁烷又名异丁烷
C. 苯和乙酸均能发生取代反应 D. C3H6有2种同分异构体且其化学性质不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)Na+与Ne互为等电子体,电离能I2(Na)___I1(Ne)(填“<”、 “=”或“>”).
(2)第四周期中,与Al原子未成对电子数相同的金属元素有___种。气态氯化铝的分子组成为(AlCl3)2,分子中所含的化学键类型有_______,Al原子的杂化方式为____。

(3)可燃冰是天然气水合物,具有笼形结构如图A(表面的小球是水分子,内部的大球是甲烷分子)。水分子成笼的作用力是_________,图A中最小的环中连接的原子总数是_________。
可燃冰晶体具有多种笼状结构,其中一种由1个图A所示笼分别用2个面与另外两个相同的笼共面而成,则中间笼实际占有____________个水分子。
(4)金属镁晶体中原子的堆积方式为六方最密堆积如图B所示,晶胞可用图C表示。设金属镁的原子半径为a cm,晶胞的高为b cm,则该晶体的空间利用率为__________(写出计算式);设晶胞中A点原子的坐标为(0,0,0),C点原子的坐标为(2a,0,0),D点原子的坐标为(0,0,b),则B点原子的坐标为__________________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com