
| A. | 常温下c(H+)为0.01 mol/L的盐酸由H2O电离出的c(H+)=1.0×10-2mol•L-1 | |
| B. | 室温下,对于0.10 mol•L-1的氨水,加水稀释后,溶液中c(NH4+)•c(OH-)变大 | |
| C. | 有关反应:(tBuNO)2??2(tBuNO),压强越大,反应物的转化率越大 | |
| D. | 反应NH3(g)+HCl(g)═NH4Cl(s)在室温下可自发进行,则该反应的△H<0 |
分析 A、盐酸溶液中的氢氧根离子来自水的电离;
B、加水稀释时,溶液中c(NH4+).c(OH-)=Kb.c(NH3.H2O);
C、增大压强,平衡向着气体体积变小的方向移动;
D、反应NH3(g)+HCl(g)═NH4Cl(s)是个熵减的反应.
解答 解:A、常温下,pH=2的盐酸中氢离子浓度为0.01mol/L,盐酸溶液中氢氧根离子为水电离的,所以由H2O电离出的c(H+)=1.0×10-12mol•L-1,故A错误;
B、加水稀释时,溶液中c(NH4+).c(OH-)=Kb.c(NH3.H2O),温度不变,电离平衡常数不变,加水稀释c(NH3.H2O)减小,所以c(NH4+).c(OH-)变小,故B错误;
C、增大压强,平衡向着气体体积变小的方向移动,即平衡左移,则反应物的转化率减小,故C错误;
D、反应NH3(g)+HCl(g)═NH4Cl(s)是个熵减的反应,故若要自发进行,则反应必须是放热反应,即△H<0,故D正确.
故选D.
点评 本题考查了反应能否自发进行以及溶液稀释时离子浓度的变化等问题,难度不大,综合性较强,注意基础的积累.


 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 小苏打Na2CO3,苛性钠NaOH | B. | 明矾KAl(SO4)2•12H2O,消石灰Ca(OH)2 | ||
| C. | 苏打NaHCO3,石灰石CaCO3 | D. | 纯碱NaOH,食盐NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
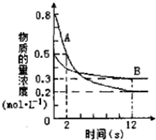 某温度下,在2L密闭容器中投入一定量的A、B发生反应:3A(g)+bB (g)?cC(g)△H=-Q kJ•mol-1(Q>0).12s 时达到平衡,生成C的物质的量为0.8mol,反应过程如图所示.下列说法正确的是( )
某温度下,在2L密闭容器中投入一定量的A、B发生反应:3A(g)+bB (g)?cC(g)△H=-Q kJ•mol-1(Q>0).12s 时达到平衡,生成C的物质的量为0.8mol,反应过程如图所示.下列说法正确的是( )| A. | 前12s内,A的平均反应速率为0.025mol•L-1•s-1 | |
| B. | 12s后,A的消耗速率等于B的生成速率 | |
| C. | 化学计量数之比b:c=1:2 | |
| D. | 12s内,A和B反应放出的热量为0.2Q kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
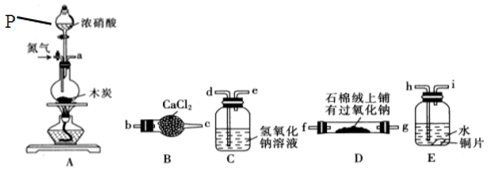
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 电离能(KJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15399 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
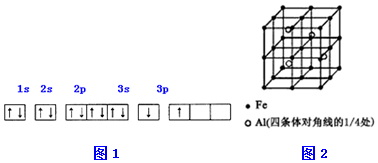
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇、乙烷和乙酸都可以与钠反应生成氢气 | |
| B. | 70%-75%(体积分数)的乙醇溶液常用于医疗消毒 | |
| C. | 苯和乙烯都可以使溴的四氯化碳溶液褪色 | |
| D. | 石油分馏可获得乙酸、苯及甲苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.15mol | B. | 0.0375mol | C. | 2.4g | D. | 19.2g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com