
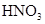 和
和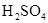 物质的量浓度分别为
物质的量浓度分别为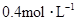 和
和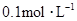 ,向该溶液中加入1.92g铜粉,加热,待充分反应后,所得溶液中
,向该溶液中加入1.92g铜粉,加热,待充分反应后,所得溶液中 物质的量浓度(
物质的量浓度(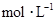 )为( )
)为( )| A.0.15 | B.0.225 | C.0.35 | D.0.45 |
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源:不详 题型:单选题
| A.Cu+HNO3→ | B.N2+O2→ |
| C.NH3+O2→ | D.NO2+H2O→ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.生成沉淀完全时消耗NaOH溶液的体积为100mL |
| B.参加反应的硝酸的物质的量为0.1mol |
| C.开始加入合金的质量可能为16.4g |
| D.标况下产物NO的体积为22.4 L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.9.02g | B.8.26g | C.8.61g | D.7.04g |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
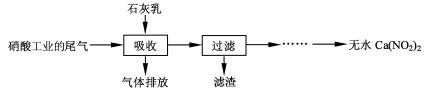
 N2O3(g),其平衡常数表达式为K=________。
N2O3(g),其平衡常数表达式为K=________。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
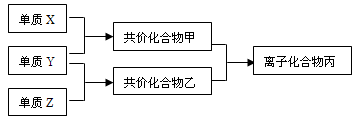
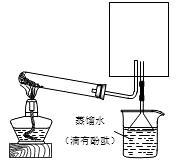
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.NO是具有刺激性的红棕色气体 |
| B.NO是汽车尾气的有害成分之一 |
| C.NO不易溶于水 |
| D.NO能够与人体血红蛋白结合,造成人体缺氧中毒 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com