
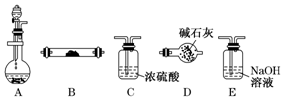
 如图是用于气体制备、干燥、性质验证、尾气处理的部分仪器装置(加热及夹持固定装置均已略去).请根据下列要求回答问题.
如图是用于气体制备、干燥、性质验证、尾气处理的部分仪器装置(加热及夹持固定装置均已略去).请根据下列要求回答问题.分析 (1)①装置A中锌片与稀硫酸反应产生H2,装置C是对H2进行干燥,然后依次通过分别盛有CuO、无水CuSO4粉末的装置B;通过CuO时,氢气与CuO反应生成Cu和H2O;通过无水CuSO4粉末时,可以检验生成的水.故实验目的是验证H2的还原性并检验其氧化产物; 装置D的作用是防止空气中的水分进入装置B,干扰产物H2O的检验.
②使B中CuO反应充分,在不改变现有药品的条件下,可以减缓A中产生氢气的速率,如控制硫酸的滴入速率、控制烧瓶的温度等.
③加热前必须检验装置中空气是否排尽或检验氢气是否纯净.
(2)①滴入浓氨水,则Na2O2与H2O反应生成O2,放热使氨水挥发,氨气逸出;
②做氨的催化氧化实验,装置A为O2、NH3的发生装置,由于产生的O2、NH3中含有水蒸气,需要通过装置D干燥后进入装置B发生催化氧化反应.
③试管B中氨气发生催化氧化.
解答 解:(1)①装置A中锌片与稀硫酸反应产生H2,装置C是对H2进行干燥,然后依次通过分别盛有CuO、无水CuSO4粉末的装置B;通过CuO时,氢气与CuO反应生成Cu和H2O;通过无水CuSO4粉末时,可以检验生成的水.故实验目的是验证H2的还原性并检验其氧化产物; 装置D的作用是防止空气中的水分进入装置B,干扰产物H2O的检验,故答案为:验证H2的还原性并检验其氧化产物;防止空气中的水进入装置,干扰H2氧化产物的检验;
②使B中CuO反应充分,在不改变现有药品的条件下,可以减缓A中产生氢气的速率,如控制硫酸的滴入速率、控制烧瓶的温度等,
故答案为:控制分液漏斗的活塞,使稀H2SO4缓慢滴下(或在烧瓶中加水或将烧瓶放入冰水中或用冰毛巾捂着烧瓶等);
③加热前必须检验装置中空气是否排尽或检验氢气是否纯净,故答案为:检验装置中空气是否排尽或检验氢气是否纯净;
(2)①滴入浓氨水,则Na2O2与H2O反应生成O2,放热使氨水挥发,氨气逸出,故答案为:O2、NH3;
②做氨的催化氧化实验,装置A为O2、NH3的发生装置,由于产生的O2、NH3中含有水蒸气,需要通过装置D干燥后进入装置B发生催化氧化反应,故答案为:A→D→B;
③试管B中的反应方程式为4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O,故答案为:4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O.
点评 本题考查了物质性质实验方案的设计与评价,涉及了过氧化钠的性质、合成氨的反应原理、氢气的实验室制法等知识,题目难度中等,正确理解反应原理为解答关键,试题充分考查了学生的分析、理解能力及化学实验能力,是一道质量不错的题目.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:选择题

| A. | 稀盐酸中加一定量CaCO3(横坐标是碳酸钙的质量,纵坐标为气体体积) | |
| B. | Ca(OH)2溶液中滴入溶液(横坐标是Na2CO3溶液的体积,纵坐标为沉淀质量) | |
| C. | 稀盐酸滴加到AgNO3溶液中(横坐标是稀盐酸的体积,纵坐标为溶液的导电能力) | |
| D. | 稀硫酸滴加到Ba(OH)2溶液中(横坐标是稀硫酸的体积,纵坐标为溶液的导电能力) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钠的摩尔质量是40 g | |
| B. | 1 mol NaOH的质量是40 g/mol | |
| C. | 1gH2和lgN2含分子数相等 | |
| D. | 等质量的N2、CH4、CO、H2O中,CH4含分子数最多 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| X | Y | |
| Z | W |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
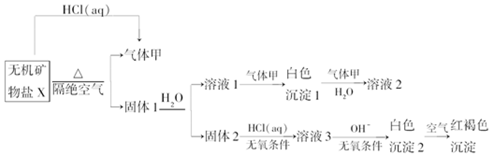
 ,写出气体甲的电子式
,写出气体甲的电子式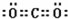 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com