

| c(NO2) |
| c(NO) |
| ClO2 |
| 反应Ⅰ |
| Na2SO3水溶液 |
| 反应Ⅱ |
| c(NO2) |
| c(NO) |
| c(NO2) |
| c(NO) |


科目:高中化学 来源: 题型:
A、 如图装置所示,可准确测定中和热 如图装置所示,可准确测定中和热 |
| B、若用50mL 0.55mo1?L-1的氢氧化钠溶液,分别与50mL 0.50mo1?L-1的盐酸和50mL0.50mo1?L-1的硫酸充分反应,两反应测定的中和热不相等 |
| C、在中和滴定实验中,滴定管用蒸馏水洗涤后,再用标准液润洗,再加进标准液 |
| D、进行中和滴定操作时,左手震荡锥形瓶,右手转动活塞控制液滴流速,眼睛要始终注视滴定管内溶液液面的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、A B C D E |
| B、E C D B A |
| C、B A D C E |
| D、C D A B E |
查看答案和解析>>
科目:高中化学 来源: 题型:

| PCl3 |
| △ |
 .写出以物质C为原料制备聚乳酸(
.写出以物质C为原料制备聚乳酸( )的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2OH
)的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2OH| 浓H2SO |
| 170℃ |
| H2 |
| 催化剂/△ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
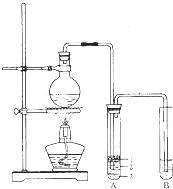 实验室制取少量溴乙烷所用试剂是乙醇和溴化氢反应;溴乙烷的密度比水大且不溶于水.实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空:
实验室制取少量溴乙烷所用试剂是乙醇和溴化氢反应;溴乙烷的密度比水大且不溶于水.实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空:查看答案和解析>>
科目:高中化学 来源: 题型:
A、按系统命名法, 的名称为3,3,6-三甲基-4-乙基庚烷 的名称为3,3,6-三甲基-4-乙基庚烷 |
B、下图是某有机物分子的比例模型,该物质可能是一种氨基酸 |
| C、能用新制氢氧化铜和NaOH溶液鉴别甘油、葡萄糖溶液、乙酸钠溶液 |
D、木糖醇 和葡萄糖 和葡萄糖 互为同系物,均属于糖类 互为同系物,均属于糖类 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 -CH=CH2)和D(HO-
-CH=CH2)和D(HO- -CHO)按如下方法合成:
-CHO)按如下方法合成:
 -ONa+RCH2I→
-ONa+RCH2I→ -OCH2R+NaI
-OCH2R+NaI| 一定条件 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、聚四氟乙烯的单体是不饱和烃 |
| B、聚四氟乙烯比较稳定 |
| C、聚四氟乙烯中氟的质量分数是73.1% |
| D、聚四氟乙烯分子中含有双键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com