
ЎҫМвДҝЎҝAЎўBЎўCЎўDЎўEОӘФӯЧУРтКэТАҙОФцҙуөДОеЦЦ¶МЦЬЖЪФӘЛШЈ¬ЖдЦРҪцә¬УРТ»ЦЦҪрКфФӘЛШЈ¬AәНDЧоНвІгөзЧУКэПаН¬Ј»BЎўCәНEФЪЦЬЖЪұнЦРПаБЪЈ¬ЗТCЎўEН¬ЦчЧеЈ®BЎўCөДЧоНвІгөзЧУКэЦ®әНөИУЪDөДФӯЧУәЛНвөзЧУКэЈ¬AәНCҝЙРОіЙБҪЦЦіЈјыөДТәМ¬»ҜәПОпЈ® Зл»ШҙрПВБРОКМвЈәЈ»
ЈЁ1Ј©BөДФӯЧУҪб№№КҫТвНјЈ»
ЈЁ2Ј©CЎўDЎўEИэЦЦФӯЧУ¶ФУҰөДАлЧУ°лҫ¶УЙҙуөҪРЎөДЛіРтКЗЈЁМоҫЯМеАлЧУЈ©Ј»УЙAЎўBЎўCИэЦЦФӘЛШ°ҙ4Јә2Јә3ЧйіЙөД»ҜәПОпЛщә¬өД»ҜС§јьАаРНКфУЪ Ј®
ЈЁ3Ј©ФЪ100mL18mol/LөДЕЁөДAЎўCЎўE ЧйіЙЛбИЬТәЦРјУИл№эБҝөДНӯЖ¬Ј¬јУИИК№Ц®ід·Ц·ҙУҰЈ¬ІъЙъөДЖшМеФЪұкЧјЧҙҝцПВөДМе»эҝЙДЬКЗЈ»ЈЁМоРтәЕЈ© aЈ®7.32L bЈ®6.72L cЈ®20.16L dЈ®30.24L
ИфК№ЙПКц·ҙУҰЦРКЈУаөДНӯЖ¬јМРшИЬҪвЈ¬ҝЙПтЖдЦРјУИлПхЛбДЖЈ¬·ҙУҰөДАлЧУ·ҪіМКҪОӘЈә Ј®
Ўҫҙр°ёЎҝ
ЈЁ1Ј©![]()
ЈЁ2Ј©S2©ҒЈҫO2©ҒЈҫNa+Ј»АлЧУјьЎў№ІјЫјь
ЈЁ3Ј©abЈ»3Cu+8H++2NO3©Ғ+=3Cu2++2NOЎь+4H2O
ЎҫҪвОцЎҝҪвЈәAЎўBЎўCЎўDЎўEОӘФӯЧУРтКэТАҙОФцҙуөДОеЦЦ¶МЦЬЖЪФӘЛШЈ¬BЎўCәНEФЪЦЬЖЪұнЦРПаБЪЈ¬ЗТCЎўEН¬ЦчЧеЈ¬ФтBЎўCҙҰУЪөЪ¶юЦЬЈ¬EҙҰУЪөЪИэЦЬЖЪЈ¬AәНDЧоНвІгөзЧУКэПаН¬Ј¬¶юХЯН¬ЦчЧеЈ¬ҪбәПФӯЧУРтКэҝЙЦӘDЦ»ДЬҙҰУЪөЪИэЦЬЖЪЈ¬BЎўCөДЧоНвІгөзЧУКэЦ®әНөИУЪDөДФӯЧУәЛНвөзЧУКэЈ¬BЎўCЧоНвІгөзЧУКэЦ®әНЧоҙуОӘ13Ј¬DөДәЛНвөзЧУКэЦ»ДЬОӘ11»т13Ј¬ЖдЦРҪцә¬УРТ»ЦЦҪрКфФӘЛШЈ¬ЗТAәНCҝЙРОіЙБҪЦЦіЈјыөДТәМ¬»ҜәПОпЈ¬ФтAОӘHФӘЛШЎўBОӘNФӘЛШЎўCОӘOФӘЛШЎўDОӘNaЎўEОӘSФӘЛШЈ®ЈЁ1Ј©BОӘNФӘЛШЈ¬ФӯЧУҪб№№КҫТвНјЈә ![]() Ј¬ЛщТФҙр°ёКЗЈә
Ј¬ЛщТФҙр°ёКЗЈә ![]() Ј»ЈЁ2Ј©АлЧУөДөзЧУІгКэФҪ¶аЈ¬ЖдАлЧУ°лҫ¶ФҪҙуЈ¬өзЧУІгҪб№№ПаН¬өДАлЧУЦРЈ¬АлЧУ°лҫ¶ЛжЧЕәЛөзәЙКэөДФцҙу¶шјхРЎЈ¬ЛщТФАлЧУ°лҫ¶ҙуРЎЛіРтКЗS2©ҒЈҫO2©ҒЈҫNa+ Ј¬ УЙAЎўBЎўCИэЦЦФӘЛШ°ҙ4Јә2Јә3ЧйіЙөД»ҜәПОпОӘNH4NO3 Ј¬ Лщә¬өД»ҜС§јьАаРНУРАлЧУјьЎў№ІјЫјьЈ¬ЛщТФҙр°ёКЗЈәS2©ҒЈҫO2©ҒЈҫNa+Ј»АлЧУјьЎў№ІјЫјьЈ»ЈЁ3Ј©ФЪ100mL 18mol/LөДЕЁH2SO4ИЬТәЦРјУИл№эБҝөДНӯЖ¬Ј¬јУИИК№Ц®ід·Ц·ҙУҰЈ¬НӯЖ¬Іҝ·ЦИЬҪвЈ¬Лж·ҙУҰҪшРРЕЁБтЛбұдОӘПЎБтЛбЈ¬ПЎБтЛбІ»УлCu·ҙУҰЈ¬БтЛбөДОпЦКөДБҝОӘ0.1mol/LЎБ18mol/L=1.8molЈ¬·ўЙъ·ҙУҰЈәCu+2H2SO4ЈЁЕЁЈ©
Ј»ЈЁ2Ј©АлЧУөДөзЧУІгКэФҪ¶аЈ¬ЖдАлЧУ°лҫ¶ФҪҙуЈ¬өзЧУІгҪб№№ПаН¬өДАлЧУЦРЈ¬АлЧУ°лҫ¶ЛжЧЕәЛөзәЙКэөДФцҙу¶шјхРЎЈ¬ЛщТФАлЧУ°лҫ¶ҙуРЎЛіРтКЗS2©ҒЈҫO2©ҒЈҫNa+ Ј¬ УЙAЎўBЎўCИэЦЦФӘЛШ°ҙ4Јә2Јә3ЧйіЙөД»ҜәПОпОӘNH4NO3 Ј¬ Лщә¬өД»ҜС§јьАаРНУРАлЧУјьЎў№ІјЫјьЈ¬ЛщТФҙр°ёКЗЈәS2©ҒЈҫO2©ҒЈҫNa+Ј»АлЧУјьЎў№ІјЫјьЈ»ЈЁ3Ј©ФЪ100mL 18mol/LөДЕЁH2SO4ИЬТәЦРјУИл№эБҝөДНӯЖ¬Ј¬јУИИК№Ц®ід·Ц·ҙУҰЈ¬НӯЖ¬Іҝ·ЦИЬҪвЈ¬Лж·ҙУҰҪшРРЕЁБтЛбұдОӘПЎБтЛбЈ¬ПЎБтЛбІ»УлCu·ҙУҰЈ¬БтЛбөДОпЦКөДБҝОӘ0.1mol/LЎБ18mol/L=1.8molЈ¬·ўЙъ·ҙУҰЈәCu+2H2SO4ЈЁЕЁЈ© ![]() CuSO4+SO2Ўь+2H2OЈ¬јЩЙиЕЁБтЛбНкИ«·ҙУҰЈ¬ЙъіЙ¶юСх»ҜБтОӘ0.9molЈ¬№ККөјКЙъіЙ¶юСх»ҜБтөДМе»эРЎУЪ0.9molЎБ22.4L/mol=20.16LЈ¬УыК№ЙПКц·ҙУҰЦРКЈУаөДНӯЖ¬јМРшИЬҪвЈ¬ҝЙПтЖдЦРјУИлBөДЧоёЯјЫә¬СхЛбЛщРОіЙөДДЖСОЈ¬јҙҪшИлNaNO3 Ј¬ ·ҙУҰөДАлЧУ·ҪіМКҪОӘЈә3Cu+8H++2NO3©Ғ+=3Cu2++2NOЎь+4H2OЈ¬№КСЎЈәabЈ»3Cu+8H++2NO3©Ғ+=3Cu2++2NOЎь+4H2OЈ®
CuSO4+SO2Ўь+2H2OЈ¬јЩЙиЕЁБтЛбНкИ«·ҙУҰЈ¬ЙъіЙ¶юСх»ҜБтОӘ0.9molЈ¬№ККөјКЙъіЙ¶юСх»ҜБтөДМе»эРЎУЪ0.9molЎБ22.4L/mol=20.16LЈ¬УыК№ЙПКц·ҙУҰЦРКЈУаөДНӯЖ¬јМРшИЬҪвЈ¬ҝЙПтЖдЦРјУИлBөДЧоёЯјЫә¬СхЛбЛщРОіЙөДДЖСОЈ¬јҙҪшИлNaNO3 Ј¬ ·ҙУҰөДАлЧУ·ҪіМКҪОӘЈә3Cu+8H++2NO3©Ғ+=3Cu2++2NOЎь+4H2OЈ¬№КСЎЈәabЈ»3Cu+8H++2NO3©Ғ+=3Cu2++2NOЎь+4H2OЈ®



| Дкј¶ | ёЯЦРҝОіМ | Дкј¶ | іхЦРҝОіМ |
| ёЯТ» | ёЯТ»Гв·СҝОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СҝОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СҝОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СҝОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СҝОіМНЖјцЈЎ | іхИэ | іхИэГв·СҝОіМНЖјцЈЎ |
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
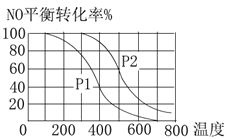
ЎҫМвДҝЎҝУРТ»·ҙУҰ:2E(g)+F(g)![]() 2G(g)Ј¬НјЦРЗъПЯКЗёГ·ҙУҰФЪІ»Н¬ОВ¶ИПВөДЖҪәвЗъПЯЈ¬yЦбұнКҫFөДЧӘ»ҜВКЈ¬НјЦРУРaЎўbЎўcИэөгЈ¬ФтПВБРГиКцЦРХэИ·өДКЗ
2G(g)Ј¬НјЦРЗъПЯКЗёГ·ҙУҰФЪІ»Н¬ОВ¶ИПВөДЖҪәвЗъПЯЈ¬yЦбұнКҫFөДЧӘ»ҜВКЈ¬НјЦРУРaЎўbЎўcИэөгЈ¬ФтПВБРГиКцЦРХэИ·өДКЗ

A. ёГ·ҙУҰКЗ·ЕИИ·ҙУҰ
B. bөгКұ»мәПЖшМеөДЖҪҫщДҰ¶ыЦКБҝІ»ФЩұд»Ҝ
C. T1ОВ¶ИПВaөгұнКҫИфПлҙпөҪЖҪәвЈ¬ҝЙТФІЙИЎФцҙуС№ЗҝөД·Ҫ·Ё
D. c өгҝЙұнVХэДж
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝУР3·ЭөИЦКБҝөДРЎЛХҙтЈ¬өЪ1·ЭЦұҪУУлСОЛбЗЎәГНкИ«·ҙУҰЈәөЪ2·ЭКЧПИјУИИЈ¬ К№ЖдІҝ·Ц·ЦҪвәуЈ¬ФЩУлЧгБҝСОЛбЗЎәГНкИ«·ҙУҰЈәөЪ3·ЭКЧПИјУИИЈ¬К№ЖдНкИ«·ЦҪвәуЈ¬ФЩУлЧгБҝСОЛбЗЎәГНкИ«·ҙУҰЎЈјЩИфСОЛбөДОпЦКөДБҝЕЁ¶ИПаН¬Ј¬ПыәДСОЛбөДМе»э·ЦұрОӘV1ЎўV2әНV3Ј¬ФтV1ЎўV2әНV3өДҙуРЎ№ШПөХэИ·өДКЗ
A. V1>V2>V3 B. V1>V3>V2 C. V2>V3 >V1 D. V1=V2=V3
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝ150ЎжКұЈ¬ПтПВНјЛщКҫөДәгС№ИЭЖчЦРјУИл4LN2әН H2өД»мәПЖшМеЈ¬ФЪҙЯ»ҜјБЧчУГПВід·Ц·ҙУҰ(ҙЯ»ҜјБМе»эәцВФІ»јЖ)Ј¬Хэ·ҙУҰ·ЕИИЎЈ·ҙУҰәу»ЦёҙөҪФӯОВ¶ИЎЈЖҪәвәуИЭЖчМейтұдОӘ3.4LЈ¬ИЭЖчДЪЖшМе¶ФПаН¬МхјюөДЗвЖшөДПа¶ФГЬ¶ИОӘ5ЎЈ

(1)·ҙУҰЗ°»мәПЖшМеЦРV(N2):V(H2)=______Ј»·ҙУҰҙпЖҪәвәуV(NH3)=__LЈ»ёГ·ҙУҰЦРN2ЧӘ»ҜВКОӘ___ЎЈ
(2)ПтЖҪәвәуөДИЭЖчЦРідИл0.2molөДNH3Ј¬Т»¶ОКұјдәу·ҙУҰФЩҙОҙпөҪЖҪәвЈ¬»ЦёҙөҪ150ЎжКұІвөГҙЛ№эіМЦРҙУНвҪзОьКХБЛ6.44 kJөДИИБҝЎЈЗл»ШҙрЈәідИлNH3КұЈ¬»мәПЖшМеөДГЬ¶ИҪ«__________(МоЎ°ФцҙуЎұЎўЎ°јхРЎЎұ»тЎ°І»ұдЎұ)Ј¬ФЪҙпөҪЖҪәвөД№эіМЦРЈ¬»мәПЖшМеөДГЬ¶ИҪ«____(МоЎ°ФцҙуЎұЎўЎ°јхРЎЎұ»тЎ°І»ұдЎұ)ЎЈ·ҙУҰЦШРВҙпЖҪәвкА»мәПЖшМе¶ФЗвЖшөДПа¶ФГЬ¶ИҪ«______5(МоЎ°>ЎұЎўЎ°<Ўұ»т Ў° = Ўұ)
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝN2H4КЗТ»ЦЦёЯР§ЗеҪаөД»рјэИјБПЎЈ8g N2H4(g)НкИ«ИјЙХЙъіЙөӘЖшәНЖшМ¬Л®КұЈ¬·Еіц133.5 kJИИБҝЎЈФтПВБРИИ»ҜС§·ҪіМКҪЦРХэИ·өДКЗ(ЎЎЎЎ)
A. ![]() N2H4(g)Ј«O2(g)=== N2(g)Ј«H2O(g)ЎЎ ҰӨHЈҪ267 kJЎӨmolЈӯ1
N2H4(g)Ј«O2(g)=== N2(g)Ј«H2O(g)ЎЎ ҰӨHЈҪ267 kJЎӨmolЈӯ1
B. N2H4(g)Ј«O2(g)===N2(g)Ј«2H2O(g)ЎЎ ҰӨHЈҪЈӯ534 kJЎӨmolЈӯ1
C. N2H4(g)Ј«O2(g)===N2(g)Ј«2H2O(g)ЎЎ ҰӨHЈҪ534 kJЎӨmolЈӯ1
D. N2H4(g)Ј«O2(g)===N2(g)Ј«2H2O(l)ЎЎ ҰӨHЈҪЈӯ133.5 kJЎӨmolЈӯ1
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝТФВБНБҝуЦчТӘіЙ·ЦКЗA12O3Ј¬ә¬ФУЦКSiO2ЎўFe2O3ЎЈ №ӨТөЙПҙУВБНБҝуЦРМбИЎВБҝЙІЙИЎИзПВ№ӨТХБчіМЈә
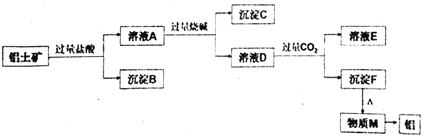
Зл»ШҙрПВБРОКМвЈә
(1)РҙіцВБНБҝуИЬҪвУЪ№эБҝСОЛбөДАлЧУ·ҪіМКҪ___________________________________ЎЈ
(2)РҙіцИЬТәAЦРјУ№эБҝЙХјоөДАлЧУ·ҪіМКҪ___________________________________ЎЈ
(3)ИЬТәDЦРНЁИл№эБҝCO2ЙъіЙіБөнFөДАлЧУ·ҪіМКҪОӘ ____________________________________ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝ¶МЦЬЖЪФӘЛШAЎўBЎўCЎўDЎўEЎўFөДФӯЧУРтКэТАҙОФцҙуЈ¬ЖдФӘЛШМШХчРЕПўИзПВұнЈә
ФӘЛШұаәЕ | ФӘЛШМШХчРЕПў |
A | СфАлЧУәЛНвОЮөзЧУ |
B | ЧоёЯХэјЫәНЧоөНёәјЫөДҫш¶ФЦөЦ®ІоОӘ2 |
C | ЧоНвІгөзЧУКэКЗДЪІгөзЧУКэөД3ұ¶ |
D | 1molDөҘЦКДЬУлАдЛ®·ҙУҰЈ¬ФЪұкЧјЧҙҝцПВЙъіЙ11.2LH2 |
E | ФӯЧУЧоНвІгөзЧУКэөИУЪЖдЦЬЖЪРтКэ |
F | ёә¶юјЫТхАлЧУөДөзЧУІгҪб№№УлArФӯЧУПаН¬ |
ЈЁ1Ј©FөДјтөҘАлЧУөДҪб№№КҫТвНјОӘЈ»
ЈЁ2Ј©EФЪЦЬЖЪұнЦРөДО»ЦГОӘЈ»
ЈЁ3Ј©CәНDјтөҘАлЧУөД°лҫ¶ҙуРЎОӘЈ»ЈЁУГАлЧУ·ыәЕәНЎ°ЈҫЎұЎўЎ°=Ўұ»тЎ°ЈјЎұұнКҫЈ©
ЈЁ4Ј©ФӘЛШ·ЗҪрКфРФЗҝИхұИҪПУРәЬ¶а·Ҫ·ЁЈ¬ЖдЦРCәНFөД·ЗҪрКфРФЗҝИхөДСРҫҝ·Ҫ°ёЦРІ»ҝЙРРөДКЗЈЁМоРтәЕЈ©Ј» aЈ®ұИҪПБҪЦЦөҘЦКөДСХЙ« ЎЎ bЈ®ұИҪПЗв»ҜОпөДОИ¶ЁРФ
cЈ®ТАҫЭБҪФӘЛШФЪЦЬЖЪұнЦРөДО»ЦГ dЈ®ТАҫЭБҪФӘЛШөҘЦКФЪЧФИ»ҪзЦРөДҙжФЪЧҙМ¬
ЈЁ5Ј©AЎўCЎўDИэЦЦФӘЛШЧйіЙөД»ҜәПОпЦРә¬УРөД»ҜС§јьОӘ Ј®
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝ(1)¶ФУЪ·ҙУҰЈә2NO(g)Ј«O2(g)![]() 2NO2(g)Ј¬ФЪЖдЛыМхјюПаН¬КұЈ¬·ЦұрІвөГNOөДЖҪәвЧӘ»ҜВКФЪІ»Н¬С№Зҝ(p1Ўўp2)ПВОВ¶Иұд»ҜөДЗъПЯ(ИзНј)ЎЈ
2NO2(g)Ј¬ФЪЖдЛыМхјюПаН¬КұЈ¬·ЦұрІвөГNOөДЖҪәвЧӘ»ҜВКФЪІ»Н¬С№Зҝ(p1Ўўp2)ПВОВ¶Иұд»ҜөДЗъПЯ(ИзНј)ЎЈ
ўЩұИҪПp1Ўўp2өДҙуРЎ№ШПөЈә________ЎЈ
ўЪЛжОВ¶ИЙэёЯЈ¬ёГ·ҙУҰЖҪәвіЈКэұд»ҜөДЗчКЖКЗ________(МоЎ°ФцҙуЎұ»тЎ°јхРЎЎұ)ЎЈ
(2)ФЪИЭ»эОӘ1.00 LөДИЭЖчЦРЈ¬НЁИлТ»¶ЁБҝөДN2O4Ј¬·ўЙъ·ҙУҰN2O4(g)![]() 2NO2(g)Ј¬ТСЦӘЛжОВ¶ИЙэёЯЈ¬ҙЛ»мәПЖшМеөДСХЙ«ұдЙоЎЈ
2NO2(g)Ј¬ТСЦӘЛжОВ¶ИЙэёЯЈ¬ҙЛ»мәПЖшМеөДСХЙ«ұдЙоЎЈ
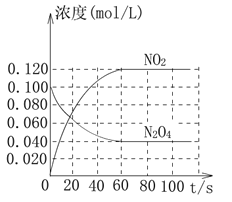
»ШҙрПВБРОКМвЈә
ўЩ·ҙУҰөДҰӨH_________________________(МоЎ°ҙуУЪЎұ»тЎ°РЎУЪЎұ)0Ј»100 ЎжКұЈ¬МеПөЦРёчОпЦКЕЁ¶ИЛжКұјдұд»ҜИзЙПНјЛщКҫЎЈФЪ0Ў«60sКұ¶ОЈ¬·ҙУҰЛЩВКv(N2O4)ОӘ____________molЎӨLЈӯ1ЎӨsЈӯ1Ј»·ҙУҰөДЖҪәвіЈКэK1ОӘ____________________ЎЈ
ўЪ100 ЎжКұҙпЖҪәвәуЈ¬ёДұд·ҙУҰОВ¶ИОӘTЈ¬c(N2O4)ТФ0.002 0 molЎӨLЈӯ1ЎӨsЈӯ1өДЖҪҫщЛЩВКҪөөНЈ¬ҫӯ10 sУЦҙпөҪЖҪәвЎЈБРКҪјЖЛгОВ¶ИTКұ·ҙУҰөДЖҪәвіЈКэK2=_________________ЎЈ
ўЫОВ¶ИTКұ·ҙУҰҙпЖҪәвәуЈ¬Ҫ«·ҙУҰИЭЖчөДИЭ»эјхЙЩТ»°лЈ¬ЖҪәвПт________________(МоЎ°Хэ·ҙУҰЎұ»тЎ°Дж·ҙУҰЎұ)·ҪПтТЖ¶ҜЈ¬ЕР¶ПАнУЙКЗ__________________________ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝПВБРёчЧйАлЧУДЬФЪИЬТәЦРҙуБҝ№ІҙжөДКЗЈЁ Ј©
A.H+ЎўNa+ЎўCO32-B.Cl-ЎўBa2+ЎўSO42-
C.H+ЎўOH-ЎўSO42-D.H+ЎўAg+ЎўNO3-
Ійҝҙҙр°ёәНҪвОц>>
°Щ¶ИЦВРЕ - Б·П°ІбБРұн - КФМвБРұн
әюұұКЎ»ҘБӘНшОҘ·ЁәНІ»БјРЕПўҫЩұЁЖҪМЁ | НшЙПУРәҰРЕПўҫЩұЁЧЁЗш | өзРЕХ©ЖӯҫЩұЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРәҰРЕПўҫЩұЁЧЁЗш | ЙжЖуЗЦИЁҫЩұЁЧЁЗш
ОҘ·ЁәНІ»БјРЕПўҫЩұЁөз»°Јә027-86699610 ҫЩұЁУКПдЈә58377363@163.com