
有原子序数依次增大的A、B、C、D、E、F六种短周期元素;A元素的原子半径是所有元素中原子最小的;C元素的最高价氧化物对应水化物与其氢化物能生成盐M;E与A同主族,且与E同周期;F元素原子的最外层电子数比次外层电子数少2;A、B、C、E、F这五种元素,每—种与D元素都能形成原子个数比不相同的若干种化合物。请回答:
(1)D元素在周期表中的位置为______________。
(2)可以比较D和F得电子能力强弱的是___________________(填写编号)。
a.比较这两种元素原子半径的大小
b.二者形成的化合物中,D元素的原子显负价
c.比较这两种元素的气态氢化物的稳定性
(3)盐M中含有的化学键类型有______________________;并写出其中阳离子的电子式_________________。
(4)已知1molE与水反应放出283.5kJ的热量,试写出E与水反应的热化学反应方程式
________________________________________________________________。
(5)固体氧化物燃料电池(SOFC)以固体氧化物作为电解质。其工作原理如下图所示。
①固体氧化物中的O2-向_________(填“正”或“负”)极移动。
②电极b为电池_________极,其电极反应式为______________________________。
③若 作为燃料气,则接触面上发生的反应为______________________________。
作为燃料气,则接触面上发生的反应为______________________________。
④若 作为燃料气,则接触面上发生的反应为________________________________。
作为燃料气,则接触面上发生的反应为________________________________。
(1)第二周期第ⅥA族(1分)
(2)bc(1分)
(3)离子键、共价键;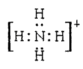 (各1分)
(各1分)
(4)2Na+2H2O=2NaOH+H2△H=―567kJ·mol―1(2分)
(5)①负(1分)②正(1分)O2+4 e―=4O2―(2分)
③H2+O2――2 e―=2H2O(2分)④C2H4+6O2――12 e―=2CO2+2H2O(2分)
解析试题分析:有原子序数依次增大的A、B、C、D、E、F六种短周期元素,A元素的原子半径是所有元素中原子最小的,所以A为H元素;C元素的最高价氧化物对应水化物与其氢化物能生成盐M,则C是N元素;E与A同主族,且与E同周期,E的原子序数大于C,所以E为Na元素;F元素原子的最外层电子数比次外层电子数少2,则F为S元素;A、B、C、E、F这五种元素,每-种与D元素都能形成原子个数比不相同的若干种化合物,则D为O元素,B为C元素,
(1)通过以上分析知,D是O元素,O元素位于第二周期第VIA族,答案为:第二周期第VIA族;
(2)比较D和F得电子能力强弱实际上就是比较两种元素的非金属性强弱,比较非金属性强弱的方法有:比较与氢气化合的难易程度、比较氢化物的稳定性、比较两种元素形成的化合物中的化合价、电负性等,故选bc;
(3)硝酸铵中 铵根离子和硝酸根离子之间存在离子键,铵根离子中氮原子和氢原子、硝酸根离子中氮原子和氧原子之间都存在共价键,铵根离子的电子式为: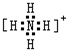 ,答案为:离子键、共价键;
,答案为:离子键、共价键;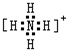 ;
;
(4)1molNa与水反应放出283.5kJ的热量,则2molNa与水反应放出567kJ热量,所以其热化学反应方程式为
2Na(s)+2H2O(l)=H2(g)↑+2NaOH(aq)△H=-567kJ·mol-1,
答案为:2Na(s)+2H2O(l)=H2(g)↑+2NaOH(aq)△H=-567kJ·mol-1;
(5)①原电池放电时阴离子向负极移动,所以O2-向负极移动,答案为:负;
②燃料电池中,正极上投放氧化剂,所以b电极是正极,正极上氧气得电子生成氧离子,所以电极反应式为O2+4e-=2O2-,故答案为:O2+4e-=2O2-;
③如果氢气为燃料,则该电极上氢气失电子和氧离子反应生成水,则电极反应式为H2+O2--2e-=H2O,答案为:H2+O2--2e-=H2O;
④如果C2H4作为燃料气,该电极上燃料失电子和氧离子反应生成二氧化碳和水,所以电极反应式为C2H4+6O2--12e-=2CO2+2H2O,
答案为:C2H4+6O2--12e-=2CO2+2H2O.
考点:位置结构性质的相互关系应用;化学电源新型电池


 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:填空题
短周期主族元素A、B、C、D、E、F的原子序数依次递增,A、B两元素相邻,B、C、E原子的最外层电子数之和为13,C原子最外层电子数是E原子最外层电子数的3倍,B、F原子最外层电子数之和等于C、E原子最外层电子数之和。
请回答下列问题:
(1)B元素在元素周期表中的位置为____________ 。
(2)元素C和D可形成两种化合物D2C、D2C2,其中均含有的化学键类型是______________;元素E、F形成的最高价氧化物对应水化物的碱性强弱关系为_____>_____ (填化学式)。
(3)E的单质能与A的最高价氧化物发生置换反应,反应的化学方程式为_____________;
(4)F的单质加入到D的最高价氧化物对应水化物的溶液中,发生反应的离子方程式为______________.
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
W、X、Y、Z是四种常见的短周期主族元素,其原子半径随原子序数的变化如下图所示。已知Y、Z的单质是空气的主要成分,W的原子半径在同周期中最小。请回答下列问题: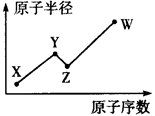
(1)写出化合物XWZ的电子式:_______________________。
(2)由W、Y两种元素组成的一种化合物M分子中,每个原子最外层均达到稀有气体的稳定结构,在工业生产中M大规模用于面粉的漂白和杀菌,写出M与水反应的化学方程式:________________。
(3)由W、X、Y、Z四种元素中的三种元素组成的某种化合物N是一种常见的化肥,若N能促进水的电离,则其化学式为____________________;若N能抑制水的电离,则其化学式为___________________。
(4)XYZ3溶液的酸性比XWZ溶液的酸性强,有人据此认为Y的非金属性强于W,你认为这种看法是否正确,说明理由:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下图是元素周期表的一部分,其中每个数字编号代表对应的一种元素。
| ① | | | ||||||
| | | | | ② | ③ | ④ | | |
| ⑤ | | ⑥ | ⑦ | | | ⑧ | ⑨ | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知A、B、C、D、E、F为元素周期表中原子序数依次增大的前20号元素,A与B;C、D与E分别位于同一周期。A原子L层上有2对成对电子, B、C、D的核外电子排布相同的简单离子可形成一种C3DB6型离子晶体X,,CE、FA为电子数相同的离子晶体。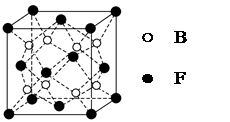
(1)写出A元素的基态原子价电子排布式 ;F离子电子排布式 。
(2)写出X的化学式
(3)试解释工业冶炼D不以DE3而是以D2A3为原料的原因: 。
(4)CE、FA的晶格能分别为786 KJ/mol l、3401KJ/mo,试分析导致两者晶格能差异的主要原因是: 。
(5)F与B可形成离子化合物,其晶胞结构如图所示:F与B形成离子化合物的化学式为________;该离子化合物晶体的密度为a g/cm3,则晶胞的体积是________________(只要求列出算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白:
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 零 |
| 2 | | | | ① | ② | ③ | | |
| 3 | ④ | | | ⑤ | | | ⑥ | ⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有A、B、C、D、E五种短周期元素,其中A元素和B元素的原子都有一个未成对电子,A+比B-少一个电子层,B原子得一个电子后3p轨道全充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价与最低化合价代数和为4;E元素的基态原子核外有六种运动状态的电子。请回答下列问题:
(1)A元素的简单离子基态时的电子排布式为 R是由C元素与氢元素两种元素形成的18电子分子,R的电子式为
(2)CB3分子的空间构型是 ,其中心原子的杂化类型是
(3)由D、E、C三元素可形成共价化合物(DEC)2(分子中各原子均达8电子稳定结构),每个分子中含 个δ键。
(4)E的一种低价氧化物与充入二氧化碳的空气和熔融碳酸钾可构成燃料电池。则该燃料电池的负极反应为 正极反应为
(5)1.2gE的单质在标准状况下的1.68L氧气中燃烧,至反应物耗尽,放出X KJ热量。则1molE与O2反应生成E的低价氧化物时的热化学方程式为 (已知:E的燃烧热为Y KJ/mol)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下图是部分短周期元素的常见化合价与原子序数的关系图: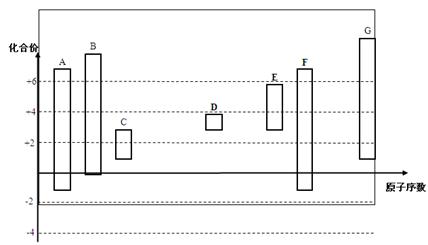
(1)元素A在周期表中的位置 。
(2)用电子式表示D2G的形成过程 其所含化学键类型为 。
(3)C2-、D+、G2-离子半径大小顺序是 > > (用离子符号回答)
(4)某同学设计实验证明A、B、F的非金属性强弱关系。 
① 溶液a和b分别为 , 。
② 溶液c中的离子方程式为 。
③请从原子结构的角度解释非金属性B > A的原因 。
(5)将0.5 mol D2C2投入100 mL 3 mol/L ECl3溶液中
① 转移电子的物质的量为 。
② 用一个离子方程式表示该反应 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有A、B、C、D、E五种短周期元素,且相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示。E的氢氧化物是两性氢氧化物, E的阳离子与A的阴离子核外电子层结构相同。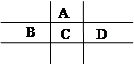
请回答下列问题:
⑴C元素在周期表中的位置为 。
⑵写出A与氢元素能形成原子物质的量之比为1∶1的化合物的结构式 ,分子中所含共价键的类型为 。
⑶比较A、C氢化物的稳定性:A C(填大于、小于或等于),原因是 。
⑷B、C、D的原子半径由大到小的顺序为(用元素符号表示) 。
⑸若将E制作成电极与石墨用导线相连,回答下列问题:
将两电极插入盛有稀H2SO4的烧杯中形成原电池,E电极为 极,写出该电池的负极的电极反应是: ;电池总反应(用离子方程式表示) 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com