
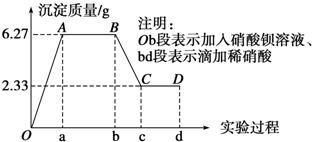
分析 依据图象分析加入硝酸钡溶液生成沉淀,加入稀硝酸,沉淀部分溶解证明水样中一定含有SO42-,CO32-,又因为Fe3+、Cu2+、Al3+与CO32-发生双水解,CO32-与Ag+、Ca2+、Mg2+发生反应生成沉淀不能大量存在,所以Fe3+、Cu2+、Al3+、Ag+、Ca2+、Mg2+不存在;依据电解质溶液中电荷守恒分析判断阳离子的存在,原溶液中可能含有Cl-,依据电解质溶液中电荷守恒,阳离子K+一定存在.
解答 解:依据图象分析加入硝酸钡溶液生成沉淀,加入稀硝酸,沉淀部分溶解证明水样中一定含有SO42-,CO32-,又因为Fe3+、Cu2+、Al3+与CO32-发生双水解,CO32-与Ag+、Ca2+、Mg2+发生反应生成沉淀不能大量存在,所以Fe3+、Cu2+、Al3+、Ag+、Ca2+、Mg2+不存在;n(SO42-)=$\frac{2.33g}{233g/mol}$=0.01mol,n(CO32-)=n(BaCO3)=$\frac{6.27g-2.33g}{197g/mol}$=0.02mol,则c(SO42-):c(CO32-)=1:2;原溶液中可能含有Cl-,依据电解质溶液中电荷守恒,阳离子K+一定存在;根据电荷守恒得到:0.01mol×2+0.02mol×2+n(Cl-)=n(K+)推知n(K+)≥0.06mol,则c(K+)≥0.06mol/L,
(1)水样中一定含有的阴离子是SO42-,CO32-;其物质的量浓度之比和=$\frac{0.01mol}{0.1L}$+$\frac{0.02mol}{0.1L}$=0.3 mol•L-1
故答案为:SO42-、CO32-;0.3 mol•L-1;
(2)BC段所表示反应是碳酸钡溶于稀硝酸的反应,反应的离子方程式:BaCO3+2H+=Ba2++CO2↑+H2O,
故答案为:BaCO3+2H+=Ba2++CO2↑+H2O;
(3)由O点到A点变化过程中是生成碳酸钡和硫酸钡沉淀的过程,结合分析中金属的硫酸根离子和碳酸根离子物质的量计算可知,消耗硝酸钡物质的量=0.01mol+0.02mol=0,03mol,
故答案为:0.03;
(4)依据电解质溶液中电荷守恒,阳离子K+一定存在,往D点的浊液中继续滴加硝酸银溶液,沉淀质量不再增加,说明原溶液中无氯离子,则原水样中阳离子物质的量之和根据电荷守恒计算得到:0.01mol×2+0.02mol×2=n(K+)推知:n(K+)=0.06mol,
故答案为:0.06.
点评 本题考查了离子反应及其计算,题目难度中等,明确常见离子的性质及检验方法为解答关键,注意掌握根据电荷守恒在判断离子存在的方法,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
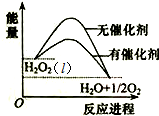
| A. | 加入催化剂,减小了反应的热效应(l) | |
| B. | 加入催化剂,不能提高H2O2的平衡转化率 | |
| C. | H2O2分解的热化学方程式:H2O2(l)═H2O(l)+$\frac{1}{2}$O2 (g)△H>0 | |
| D. | 无法比较反应物的总能量和生成物的总能量的相对大小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 吸热183 kJ | B. | 放热183 kJ | C. | 放热91.5 kJ | D. | 吸热91.5 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C8H18(l)+$\frac{25}{2}$O2(g)═8CO2(g)+9H2O△H=-48.40 kJ/mol | |
| B. | C8H18(l)+$\frac{25}{2}$O2(g)═8CO2(g)+9H2O(l)△H=-5518 kJ/mol | |
| C. | C8H18(l)+$\frac{25}{2}$O2(g)═8CO2(g)+9H2O(l)△H=+5518 kJ/mol | |
| D. | C8H18(l)+$\frac{25}{2}$O2(g)═8CO2(g)+9H2O(l)△H=+48.40 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 组成元素相同,组成元素的质量分数也对应相等的不同化合物,一定互为同分异构体 | |
| B. | 组成元素相同,相对分子质量相同的几种化合物,互为同分异构体 | |
| C. | 摩尔质量相同,各元素质量分数也对应相等的不同化合物,一定是同分异构体 | |
| D. | 凡是分子组成相差一个或几个CH2原子团的物质,彼此一定是同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 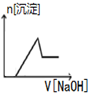 | B. | 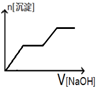 | C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com