
| A. | 0.1mol/L | B. | 0.2mol/L | C. | 0.8mol/L | D. | 1mol/L |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 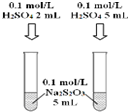 可以探究H2SO4浓度对反应速率的影响 | |
| B. | 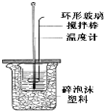 用于测定中和热时应该用稍过量的NaOH溶液和盐酸反应 | |
| C. | 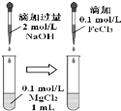 可以探究Mg(OH)2能否转化成Fe(OH)3 | |
| D. | 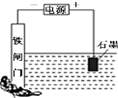 中金属防护方法叫做牺牲阳极的阴极保护法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验目的 |
| A | 将NaOH溶液滴入某溶液中,加热,放出的气体 能使湿润的红色石蕊试纸变蓝 | 证明该溶液中存在NH4+ |
| B | 向某溶液中加入稀盐酸,放出无色气体,将气体通入 澄清石灰水,石灰水变浑浊 | 证明该溶液中存在CO32- |
| C | 将Cl2通入品红溶液中,品红溶液褪色 | 证明Cl2具有漂白性 |
| D | 将酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色 | 证明H2O2氧化性比Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
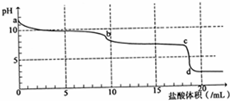 常温下,用0.2mol•L-1HCl溶液滴定10mL浓度为0.2mol•L-1 Na2CO3溶液,所得滴定曲线如图所示.下列说法不正确的是( )
常温下,用0.2mol•L-1HCl溶液滴定10mL浓度为0.2mol•L-1 Na2CO3溶液,所得滴定曲线如图所示.下列说法不正确的是( )| A. | a点时:c(H+)+c(HCO3-)+2c(H2CO3)=c(OH-) | |
| B. | 当盐酸加入5mL时:c(CO32-)+c(HCO3-)+c(H2CO3)=2c(Cl-) | |
| C. | 当盐酸加入10mL时:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| D. | b-c段发生的反应为:HCO3-+H+=CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
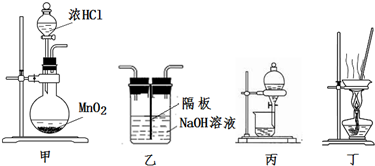
| A. | 用装置甲制取氯气 | |
| B. | 用装置丙分离二氧化锰和氯化锰溶液 | |
| C. | 用装置乙吸收制取氯气的尾气 | |
| D. | 用装置丁蒸干氯化锰溶液制 MnCl2•4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | c (Cl-)>c(Ac-)>c(HAc)>c(H+) | B. | c(Ac-)+c(HAc)=0.1mol/L | ||
| C. | c (Na+)>cH+)>c(Ac-)>c(OH-) | D. | c(Na+)+c (H+)=c(Ac-)+c(Cl-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡前,随着反应的进行,容器内压强始终不变 | |
| B. | 平衡时,分离出少量D,A的转化率提高 | |
| C. | 平衡时,升高温度,容器内混合气体的密度减小 | |
| D. | 平衡时,充入C,该反应平衡常数减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
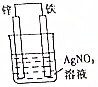 原电池原理的发现是储能和功能技术的巨大进步,是化学对人类的一项重大贡献.
原电池原理的发现是储能和功能技术的巨大进步,是化学对人类的一项重大贡献.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com