
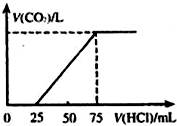
 有10mL NaOH溶液,向其中通入一定量的CO2,得到了Na2CO3和NaHCO3的混合溶液.向所得溶液中逐滴加入0.1mol/L的盐酸,边加边振荡,使其充分反应,产生CO2气体的体积(标准状况)与所加盐酸体积之间的关系如图所示.
有10mL NaOH溶液,向其中通入一定量的CO2,得到了Na2CO3和NaHCO3的混合溶液.向所得溶液中逐滴加入0.1mol/L的盐酸,边加边振荡,使其充分反应,产生CO2气体的体积(标准状况)与所加盐酸体积之间的关系如图所示.分析 (1)碳酸钠、碳酸氢钠的混合物中进入盐酸,碳酸根离子先与氢离子反应生成碳酸氢根离子,然后碳酸氢根离子与氢离子反应生成二氧化碳气体和水,据此写出反应的离子方程式;
(2)根据图象数据及反应方程式计算出碳酸钠、碳酸氢钠的物质的量,再计算出其物质的量之比;
(3)由于反应产物为碳酸钠、碳酸氢钠的混合物,所以氢氧化钠完全反应,根据钠原子守恒计算出氢氧化钠的物质的量浓度;根据碳原子守恒计算出二氧化碳的物质的量.
解答 解:(1)向Na2CO3和NaHCO3的混合溶液中滴加盐酸,0-25mL时首先发生反:CO32-+H+═HCO3-,25mL以后碳酸根离子完全转化成碳酸氢根离子,再发生反应:HCO3-+H+═CO2↑+H2O,
故答案为:CO32-+H+═HCO3-;HCO3-+H+═CO2↑+H2O;
(2)碳酸钠与盐酸反应的离子方程式为:CO32-+H+═HCO3-,消耗盐酸的物质的量为:0.1mol/L×0.025L=0.0025mol,则碳酸钠的物质的量为:0.0025mol;
碳酸氢根离子消耗盐酸的物质的量为:0.1mol/L×(0.075-0.025)L=0.005mol,碳酸氢根离子的物质的量为0.005mol,其中碳酸钠生成的碳酸氢根离子0.0025mol,则碳酸氢钠的物质的量为0.0025mol,
所以碳酸钠、碳酸氢钠的物质的量之比为:0.0025mol:0.0025mol=1:1,
故答案为:1:1;
(3)反应产物为Na2CO3和NaHCO3的混合溶液,所以氢氧化钠完全反应,根据钠原子守恒,氢氧化钠的物质的量为:0.0025mol×2+0.0025mol=0.0075mol,氢氧化钠溶液的浓度为:$\frac{0.0075mol}{0.01L}$=0.75mol/L;
根据碳原子守恒,通入二氧化碳的物质的量为:0.0025mol+0.0025mol=0.005mol,
所以通入的标况下的二氧化碳的体积为:22.4L/mol×0.005mol=0.112L=112mL,
故答案为:0.75mol/L;112mL.
点评 本题考查了碳酸钠、碳酸氢钠的性质及混合物组成的计算,题目难度中等,注意掌握碳酸钠、碳酸氢钠的性质及根据化学方程式进行的简单计算方法,正确分析、理解图象信息是解题关键.


科目:高中化学 来源: 题型:选择题
| A. | $\frac{1}{2}$(10-9+10-11) mol•L-1 | B. | 2×10-11mol•L-1 | ||
| C. | (1×10-14-5×10-4) mol•L-1 | D. | (10-9+10-11) mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
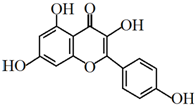 山萘酚(Kaempf erol)结构如图所示,且大量存在于水果、蔬菜、豆类、茶叶中,具有多种生物学作用,如抗氧化、抑制肿瘤生长及保护肝细胞等作用.下列有关山萘酚的叙述正确的是( )
山萘酚(Kaempf erol)结构如图所示,且大量存在于水果、蔬菜、豆类、茶叶中,具有多种生物学作用,如抗氧化、抑制肿瘤生长及保护肝细胞等作用.下列有关山萘酚的叙述正确的是( )| A. | 结构式中含有羟基、醚键、酯基、碳碳双键 | |
| B. | 可发生取代反应、水解反应、加成反应 | |
| C. | 可与NaOH反应,不能与NaHCO3反应 | |
| D. | 1 mol山萘酚与溴水反应最多可消耗4 mol Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
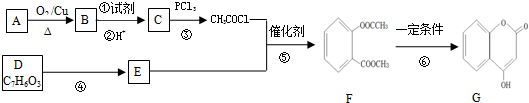
 、
、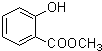 .
.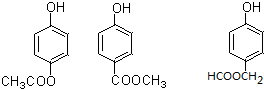 (写出一种即可).
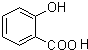
(写出一种即可).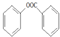 )是一种重要的有机合成中间体,参照化合物G的上述合成路线,设计一条以苯酚和甲苯为起始原料制备苯甲酸苯酚酯的合成路线
)是一种重要的有机合成中间体,参照化合物G的上述合成路线,设计一条以苯酚和甲苯为起始原料制备苯甲酸苯酚酯的合成路线 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
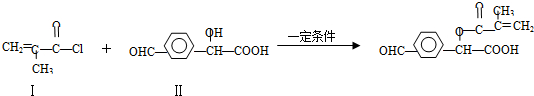
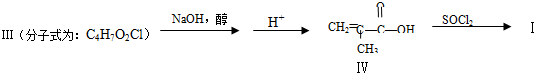
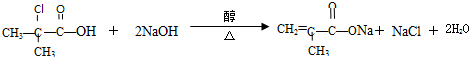 .
.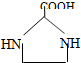 与足量的化合物Ⅰ在一定条件下也能发生类似反应①的反应,生成有机化合物Ⅵ,则Ⅵ的结构简式为
与足量的化合物Ⅰ在一定条件下也能发生类似反应①的反应,生成有机化合物Ⅵ,则Ⅵ的结构简式为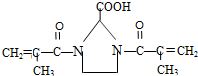 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径顺序为X>Y | |
| B. | X、Y形成的化合物含共价键和离子键 | |
| C. | XY2分子中所有原子最外层均达到8电子稳定结构 | |
| D. | Y单质与氢气的混合气体光照条件下容易发生爆炸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温常压下,2.24L SO2与O2混合气体中所含氧原子数为0.2NA | |
| B. | 标准状况下,20g D2O分子中所含中子数为10NA | |
| C. | 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA | |
| D. | 50mL 12mol•L-1盐酸与足量MnO2共热,转移的电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+ Na+ OH- | B. | Al3+ NO3- Cl- | ||
| C. | K+ H+ HCO3- | D. | Mg2+ Ca2+ SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com