
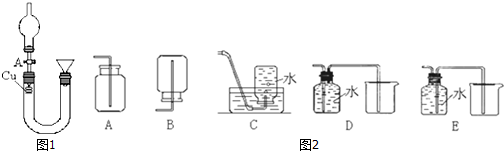
| ||
| ||


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:
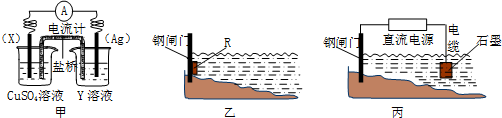
| ||
| 充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙醇 | B、丙醇 | C、丁醇 | D、甲醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含2NA个氢分子的氢气 |
| B、17g氨气(NH3的摩尔质量为17g?mol-l) |
| C、0.8mol氧气 |
| D、标准状况下11.2 L氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲烷的燃烧热为-890.3kJ?mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ?mol-1 |
| B、NaOH(aq)+CH3COOH (aq)=CH3COONa(aq)+H2O(l)△H=-57.3kJ/mol (中和热) |
| C、测定HCl和NaOH反应的中和热时,每次实验均应测量3个温度,即盐酸起始温度、NaOH起始温度和反应后终止温度 |
| D、2H2 (g)+O2(g)=2H2O(l)△H=-571.6kJ/mol (燃烧热) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | NaOH溶液的浓度 (mol/L) | 滴定完成时,消耗NaOH溶液的体积(mL) | 待测盐酸溶液的体积(mL) |
| 1 | 0.10 | 20.02 | 20.00 |
| 2 | 0.10 | 20.00 | 20.00 |
| 3 | 0.10 | 19.00 | 20.00 |
| 4 | 0.10 | 19.98 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com