
 7N2(g)��12H2O(g)Ҳ�ɴ���NO2����ѧƽ�ⳣ������ʽK��______����ת��1.2mol����ʱ�����ĵ�NO2�ڱ�״������_______L��
7N2(g)��12H2O(g)Ҳ�ɴ���NO2����ѧƽ�ⳣ������ʽK��______����ת��1.2mol����ʱ�����ĵ�NO2�ڱ�״������_______L�� 
 CO2��H2(g) ��Ӧ�����вⶨ�IJ������ݼ��±�������t1��t2��
CO2��H2(g) ��Ӧ�����вⶨ�IJ������ݼ��±�������t1��t2�� 


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ||
|
| NO | - 3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
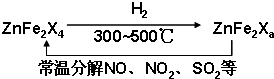
| a |
| Vd-a |
| 1000a |
| 35V |
| 1000b |
| V |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
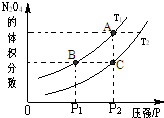 �о�CO��NO��NO2����������ʣ��Ա�������Ⱦ����Ϊ�������Ա�����������Լ��Դ����������ѧ֪ʶ������������⣺
�о�CO��NO��NO2����������ʣ��Ա�������Ⱦ����Ϊ�������Ա�����������Լ��Դ����������ѧ֪ʶ������������⣺| c(H2)?c(CO) |
| c(H2O) |
| �¶�/�� | 400 | 500 | 800 |
| ƽ�ⳣ��K | 9.94 | 9 | 1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012ѧ�꽭��ʡ�ձ����У��졢���������ޣ�����3��������ѧ�Ծ��������棩 ���ͣ������
��14�֣��о�NO2��SO2 ��CO�ȴ�����Ⱦ����IJ���������������Ҫ���塣
��1��I2O5��ʹH2S��CO��HC1�������������ڶ����ⶨCO�ĺ�������֪��
2I2(s) + 5O2(g)= 2I2O5(s) ��H=��75.56 kJ��mol��1
2CO(g) + O2(g)= 2CO2(g) ��H=��566.0 kJ��mol��1
д��CO(g)��I2O5(s)��Ӧ����I2(s)��CO2(g)���Ȼ�ѧ����ʽ�� ��
��2��һ�������£�NO2��SO2��Ӧ����SO3��NO�������塣�������Ϊ1��2��NO2��SO2���������ܱ������з���������Ӧ��������˵����Ӧ�ﵽƽ��״̬���� ��
a����ϵѹǿ���ֲ��� b�����������ɫ���ֲ���
c��SO3��NO������ȱ��ֲ��� d��ÿ����1 mol SO2��ͬʱ����1 molNO
���������Ӧƽ��ʱNO2��SO2�����Ϊ1��6����ƽ�ⳣ��K�� ��
��3�����Ͱ��������������Ļ�ѧԭ���Dz��ð�ˮ���������е�SO2������һ�������������������ղ��ﷴӦ���ü������ŵ�����ܻ�������SO2�⣬���ܵõ�һ�ָ��Ϸ��ϣ��ø��Ϸ��Ͽ��ܵĻ�ѧʽΪ ��д��һ�ּ��ɣ���
��4����ͼ��һ��̼����ȼ�ϵ�أ�MCFC������ˮú����CO��H2��Ϊȼ�ϣ�һ������Li2CO3��Na2CO3���ۻ����Ϊ����ʡ�д��B���缫��Ӧʽ ��

��5����ҵ�ϳ���Na2CO3��Һ���շ����������������NO��NO2�Ļ����Ϊ������
��֪��NO������Na2CO3��Һ��Ӧ��
NO + NO2 + Na2CO3 = 2NaNO2 + CO2
2NO2 + Na2CO3 = NaNO2 + NaNO3 + CO2
����������Na2CO3��Һ��ȫ����NO��NO2�Ļ���ÿ����22.4L����״����CO2��ȫ���ݳ���ʱ������Һ����������44g������������NO��NO2�������Ϊ ��
����Na2CO3��Һ���շ�����������������ڵ�ȱ���� ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com