
| A. | 自来水 | B. | 0.5mol/L盐酸 | C. | 0.5mol/LHAc溶液 | D. | 0.5mol/LKCl溶液 |
分析 电解质溶液导电性强弱与离子浓度成正比,与电荷成正比,如果把0.05molNaOH固体分别加入到100ml下列液体中,溶液导电能力变化最小,反应加入NaOH固体前后离子浓度变化最小,据此分析解答.
解答 解:电解质溶液导电性强弱与离子浓度成正比,与电荷成正比,如果把0.05molNaOH固体分别加入到100ml下列液体中,溶液导电能力变化最小,反应加入NaOH固体前后离子浓度变化最小,
A.加入到自来水中,水中离子浓度很小,加入NaOH后溶液中离子浓度变化较大,则溶液导电能力变化较大,故A不选;
B.加入到0.5mol/L的稀盐酸中,二者恰好完全反应生成强电解质NaCl,HCl、NaCl都是强电解质,在加入NaOH固体前后离子浓度变化不大,则溶液导电能力变化不大,故B选;
C.HAc是弱电解质,离子浓度较小,溶液导电性较弱,加入NaOH固体后,二者恰好完全反应生成强电解质醋酸钠,离子浓度变化较大,则溶液导电能力变化较大,故C不选;
D.KCl是强电解质,加入NaOH后,二者不反应,但溶液中离子浓度增大一倍,则溶液导电能力增大一倍,溶液导电能力变化较大,故D不选;
故选B.
点评 本题以溶液导电能力强弱为载体考查离子反应,为高频考点,侧重考查学生分析判断能力,明确溶液导电性强弱影响因素及物质之间的反应是解本题关键,注意:溶液导电性强弱与电解质强弱及物质溶解性强弱都无关,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 上述参加反应的NH3和生成H2的体积之比为3:2 | |
| B. | 同温同压下,NH3、H2的密度之比为2:17 | |
| C. | 相同质量的NH3、H2分子数之比为17:2 | |
| D. | 同温同体积下,相同质量NH3、H2的压强之比为2:17 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、HCO3-、CO32-、Br- | B. | SO32-、HSO3-、OH-、K+ | ||
| C. | Fe3+、Cu2+、NO3-、SO32- | D. | H+、Na+、NO3-、Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,其中氮的化合价为-2;
,其中氮的化合价为-2;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
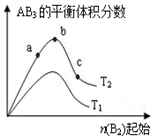 某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)?2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度,n表示物质的量),根据如图判断:
某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)?2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度,n表示物质的量),根据如图判断:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 打开汽水瓶盖,冒出大量气泡 | |
| B. | 实验室常用排饱和食盐水法收集Cl2 | |
| C. | 平衡体系2NO2?N2O4△H<0,升高温度,颜色变深 | |
| D. | 平衡体系H2(g)+I2(g)?2HI(g),缩小体积,颜色变深 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2和O2反应生成水 | B. | CuO投入稀硫酸中 | ||
| C. | 高温煅烧石灰石制CO2 | D. | NaOH溶液和K2SO4溶液混合 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com