
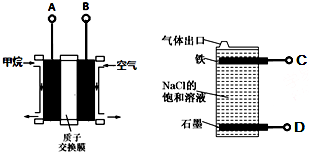
| A. | 燃料电池的A极连接电解池的C极 | |
| B. | 燃料电池工作时当0.2 NA个H+通过质子交换膜移向右边,饱和食盐水中可产生2.24L气体 | |
| C. | A电极的电极反应式为:CH4-8e-+2H2O═CO2+8H+ | |
| D. | 电解池总反应式为NaCl+H2O$\frac{\underline{\;电解\;}}{\;}$NaClO+H2↑ |
分析 利用甲烷燃料电池电解饱和食盐水制备漂白液的原理:在阴极上产生氢气,氢气密度比空气小,C处产生的是氢气,活性电极铁也只能在这里作阴极;在阳极上产生氯气和氢氧化钠,氯气和氢氧化钠反应生成氯化钠和次氯酸钠和水,则D处产生的是氯气,根据原本电池的工作原理以及电极反应式来回答判断.
解答 解:利用甲烷燃料电池电解饱和食盐水制备漂白液的原理:在阴极上产生氢气,氢气密度比空气小,C处产生的是氢气,活性电极铁也只能在这里作阴极;在阳极上产生氯气和氢氧化钠,氯气和氢氧化钠反应生成氯化钠和次氯酸钠和水,则D处产生的是氯气.
A.燃料电池中通入燃料甲烷的电极A是负极,C是阴极,A极连接电解池的C极,故A正确;
B.但未指明标况,不能确定气体体积,故B错误;
C.A电极是负极,燃料发生失电子的氧化反应,其电极反应式为:CH4-8e-+2H2O=CO2+8H+,故C正确;
D.电解饱和食盐水制备漂白液次氯酸钠,电解池总反应式为NaCl+H2O$\frac{\underline{\;电解\;}}{\;}$NaClO+H2↑,故D正确;
故选B.
点评 本题考查了原电池和电解池原理及物质的量的有关计算,注意知识的归纳和梳理是解题的关键,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | NA个氧气分子与NA个氖气分子的质量比是4:5 | |
| B. | 17gOH-与19gH3O+所含电子数相等 | |
| C. | 32gSO2和40gSO3所含的原子数相等 | |
| D. | 标准状况下,11.2LCO2与常温常压下17gNH3所含分子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | -- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol H2SO4的质量为98g•mol-1 | |
| B. | H2SO4的摩尔质量为98g | |
| C. | 9.8 g H2SO4含有NA个H2SO4分子 | |
| D. | 6.02×1022个H2SO4分子的质量为9.8g |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 氯元素可以形成HClO、HClO2、HClO3、HClO4多种含氧酸.
氯元素可以形成HClO、HClO2、HClO3、HClO4多种含氧酸.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 2mL 0.1mol/L的NaOH溶液中滴加2滴0.1mol/L的MgCl2溶液,再滴加2滴0.1mol/L的FeCl3溶液 | 白色沉淀转化为红褐色沉淀 | 溶解度:Mg(OH)2>Fe(OH)3 |
| B | 常温下,相同的铝片分别投入足量的稀、浓硫酸中 | 浓硫酸中铝片先溶解完 | 反应物浓度越大,反应速率越快 |
| C | 向2mL 2%的CuSO4溶液中加入0.5mL 1%的NaOH溶液,振荡后加入几滴有机试剂X的溶液,加热 | 未出现砖红色沉淀 | 有机试剂X中不含醛基 |
| D | NaHCO3溶液与NaAlO2溶液混合 | 生成白色沉淀 | 结合H+的能力:CO32-<AlO2- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量W,逆反应速率增大 | |
| B. | 通入一定量氦气,压强增大,平衡向正反应方向移动 | |
| C. | 升高温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动 | |
| D. | 降低温度,正反应速率减小,逆反应速率也减小,平衡向逆反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
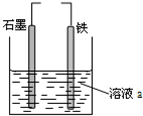
| A. | 若两电极直接连接,a是食盐水,则发生析氢腐蚀 | |
| B. | 若铁接电源负极,石墨接电源正极,a是稀H2SO4溶液,电解一段时间后溶液的pH增大 | |
| C. | 若两电极直接连接,则电子从铁流向石墨 | |
| D. | 若铁接电源正极,石墨接电源负极,a是氯化铜溶液,阴离子向石墨电极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
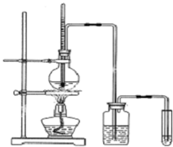 如图是实验室制乙烯并检验其性质的装置图,请回答:
如图是实验室制乙烯并检验其性质的装置图,请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com