
| A. | 原子 | B. | 分子 | C. | 阳离子 | D. | 阴离子 |
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ①~⑧是元素周期表中前四周期的8种元素,其相对位置如图所示.
①~⑧是元素周期表中前四周期的8种元素,其相对位置如图所示. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将 SO2通入水中 | B. | 烧碱溶于水 | C. | 将 HCl 通入水中 | D. | NaHSO4溶于水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
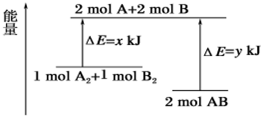
| A. | 该反应是吸热反应 | |
| B. | 断裂 1mol A-A 键和 1mol B-B 键能放出xkJ 的能量 | |
| C. | 断裂 2mol A-B 键需要吸收ykJ 的能量 | |
| D. | 2mol AB 的总能量高于 1 mol A2和 1mol B2的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 核内有 8 个中子的碳原子:68C | B. | 羰基硫(COS)的结构式: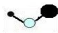 | ||
| C. | 乙烯的比例模型: | D. | NH4Br 的电子式: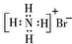 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
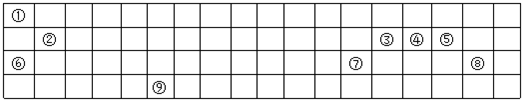
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2、N2O5、CO、Cl2 | B. | Al2O3、Cl2、N2O5、SO3 | ||
| C. | CO2、Al(OH)3、CaO、SO2 | D. | Al2O3、CO2、SO3、SO2 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省高一上10月月考化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的数值,下列叙述正确的是( )
A.常温常压下,22.4L CCl4、CO2含有的分子数为1NA
B.常温常压下,1.06g Na2CO3含有的钠离子数为0.02NA
C.通常状况下,NA个CO2分子占有的体积约为22.4 L
D.物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为1NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com