
【题目】已知:2X(g)+Y(g)a Z(g),在T1温度下,体积为2L的密闭容器中,充入6mol X和2mol Y.根据图示回答: 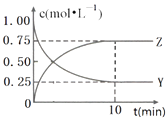
(1)a=;用Y的浓度变化表示从反应开始到平衡时的平均反应速率为mol/(Lmin).
(2)平衡时,Y在混合物中的物质的量分数是
(3)其他条件不变时,下列措施可以提高Y的转化率的是(选填字母).
A.使用适当的催化剂
B.分离出Z
C.增大容器体积.
【答案】
(1)1;0.075
(2)10%
(3)B
【解析】解:(1)在体积为2L的密闭容器中充入6molX和2molY,X、Y的起始浓度分别为3mol/L、1mol/L,平衡时X、Y、Z浓度变化之比为△c(x):(1.00mol/L﹣0.25mol/l):0.75mol/L=2:1:1,故a=1,△c(x)=1.5mol/L,用Y的浓度变化表示从反应开始到平衡时的平均反应速率为 ![]() =
= ![]() =0.075mol/L,
=0.075mol/L,
所以答案是:1;0.075mol/(Lmin);
(2.)平衡时n(X)=(3mol/L﹣1.5mol/L)×2L=3mol,n(Y)=0.25mol/L×2L=0.5mol,n(Z)=0.75mol/L×2L=1.5mol,则Y在混合物中的物质的量分数= ![]() =
= ![]() ×100%=10%,
×100%=10%,
所以答案是:10%;
(3.)反应2X(g)+Y(g)Z(g),提高Y的转化率,即使平衡正向移动,
A.催化剂不影响平衡平衡,故A错误;
B.分离出Z,平衡正向移动,Y转化率增大,故B正确;
C.增大容器体积,压强减小平衡逆向移动,Y转化率减小,故C错误;
所以答案是:B.
【考点精析】认真审题,首先需要了解化学平衡状态本质及特征(化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效)).


科目:高中化学 来源: 题型:
【题目】氢气燃烧生成液态水的热化学方程式是2H2(g)+O2(g)===2H2O(1) ΔH=-572 kJ·mol-1。请回答下列问题:
(1)生成物能量总和________(填“大于”“小于”或“等于”)反应物能量总和。
(2)若2 mol氢气燃烧生成水蒸气,则放出的热量________(填“大于”“小于”或“等于”)572 kJ。
(3)H2的标准燃烧热ΔH=________。
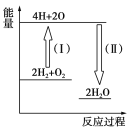
(4)反应2H2+O2![]() 2H2O的能量变化如图所示。
2H2O的能量变化如图所示。
已知拆开1 mol H2、1 molO2和1 mol H—O中的化学键分别需要消耗436 kJ、496 kJ和463 kJ的能量。
则反应过程(Ⅱ)________(填“吸收”或“放出”)________kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A. NaCl的摩尔质量是58.5g/mol B. 1mol NaOH的质量是40g
C. 1mol氮的质量是14g D. 摩尔不是物理量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列物质所含粒子数为0.2NA的是( )
①标准状况下,2.24L Cl2中含有的共价键数
②常温下,2L pH=13的Na2CO3溶液中含有的OH﹣离子数
③100mL 1.0mo1L﹣1的NaAlO2溶液中含有的氧原子数
④标准状况下,2.24L Cl2与足量的NaOH溶液反应时转移的电子数
⑤3.2gO2和O3的混合气体中含有的氧原子数
⑥3.9g Na2O2晶体中所含的离子总数.
A.②③⑥
B.②⑤
C.③⑤⑥
D.④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素的叙述正确的是( )
A.金属元素与非金属元素能形成共价化合物
B.只有在原子中,质子数才与核外电子数相等
C.目前使用的元素周期表中,最长的周期含有36种元素
D.非金属元素形成的共价化合物中,原子的最外层电子数只能是2或8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验,能成功的是
A.苯和溴水、铁屑混合制溴苯
B.用溴水除乙烷中混有的乙烯
C.苯与浓硝酸和浓硫酸的混合物共热至70℃~80℃制硝基苯
D.用酒精和浓盐酸通过加热来制取乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述前者属于化学变化,后者属于物理变化的是( )
A. 汽油挥发 酒精燃烧 B. 食物腐烂 水蒸发
C. 铁铸成锅 蜡烛燃烧 D. 滴水成冰 水加热变成水蒸气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式表达正确的是(![]() 的绝对值均正确)
的绝对值均正确)
A. C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(g) △H=–1367.0 kJ/mol(燃烧热)
B. NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1) △H= +57.3kJ/mol(中和热)
C. S(s)+O2(g)=SO2(g) △H=–269.8kJ/mol (反应热)
D. 2NO2=O2+2NO △H= +116.2kJ/mol (反应热)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是一种香料,存在于金橘中,可用如下路线合成: 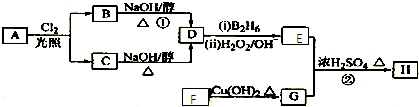
已知:R﹣CH=CH2 ![]() R﹣CH2CH2OH(B2H6为乙硼烷)
R﹣CH2CH2OH(B2H6为乙硼烷)
回答下列问题:
(1)11.2L(标准状况)的烃A在氧气中充分燃烧可以产生88g CO2和45g H2O.A的分子式是
(2)B和C均为一氯代烃,它们的名称(系统命名)分别为
(3)在催化剂存在下1mol F与2mol H2反应,生成3﹣苯基﹣1﹣丙醇.F的结构简式是
(4)反应①的反应类型是;
(5)反应②的化学方程式为
(6)写出所有与G具有相同官能团的G的芳香类同分异构体的结构简式: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com